Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Теория травки хроматов кислотами144
Перевод монохроматов в бихроматы основан на равновесии: 2CrOf + 2Н+ 2HCrOJ Cr20^ + Н20
■ В результате гидролиза в растворе монохромата содержат - Ся ионы CrOf, HCrOJ и ОН". При введении в этот раствор
Кислоты НА в нем появляются также ионы Н+ и А~. Очевидно, система будет стремиться к состоянию равновесия, определяемому в общем случае константами равновесия протекающих между ионами обратимых реакций и растворимостями компонентов. При расчете равновесий между хроматами и кислотами можно допустить, что практически соли как сильные электролиты полностью диссоциированы и что в растворе отсутствуют гидробихроматные
ИОНЫ НСГ2О7.
7 При условии, что все компоненты системы хорошо растворимы, т. е. не выпадают в твердую фазу, как, например, бывает при травке серной кислотой, ионный состав и степень перехода определяются следующими уравнениями: константа диссоциации травящей кислоты:
К _МЁ1 /п
Kl---------- [НА] (,)
Константа диссоциации гидрохроматного иона:
Kt~ [НСг04-] (2)
Константа гидролиза бихроматного иона:
[HCrOif
Значения К2 и Кз пока точно не установлены. Приводятся значения: для Kz от 0,9-Ю"7 до 1,26-10"6, для Кг от 0,91 • Ю-2 до 3,03- 10-2 (при 25°).
Если обозначить начальную молярную концентрацию кислоты а И начальнуюконцентрацию хромата с, то
А — [НА] + [А-] (4)
С = [СгО2-] + J^HCrOj] + 2 [Cr202-] (5)
Условие электронейтральиости раствора (концентрацией Н+ и ОН - можно пренебречь) отвечает уравнению
[м+] = 2 [СгО2"] + 2 [Сг202~] + [НСгО« ] + [А"] = [СгО[20]~] + с + [А~] Откуда, учитывая, что [М+] = 2с, получаем:
# = [СГ02"] + [А1 (6)
Степень перехода:
^ С-[СгОГ] T [CrOt] ^
|
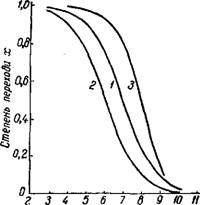
-Lg К, Рис. 174. Зависимость степени перехода хромата в бихромат от константы диссоциацчи травящей кислоТы при а = с: |
|
1-Кг = 10-7;2-.Fa = 8.ю-7; $-Кг-10~7 Н Bi =0,05 с. |
Совместное решение уравнений (1 — 7) приводит к выражению 2К (1 — х)2 (а - сх)2 + KiK2K3X (1 - х) (а - сх) = ккйсх3 (8)
Из которого можно определять х методом последовательного приближения или графически.
Допущение отсутствия бихроматных ионов в растворе (пренебречь ими можно уже при величинах Кз, больших единицы) приводит к более упрощенному уравнению для степени перехода
К) (а + с) - Ук (с - а)2 + 4/С1/С2ас
В первом приближении можно принять линейную зависимость растворимости МА в хроматно-бихроматных растворах от степени перехода. По значениям для крайних точек можно найти
|
[А"] = |
|
Или |
Ti)
[М+] 2с [А-] = Ьх + Ьгх
Где = - gj — растворимость МА в хроматном, Ь — в бихроматном растворе, а = Ъ — Ь.
Уравнение (5) в данном случае будет иметь вид [НА] + [А~] =(1—у)а
(12)
Где у— степень перехода кислоты в виде соли МА в твердую фазу.
Так как [М+] = 2с — уа, то из условия электронейтральности раствора следует:
С + [НА] = а + [СгО2-] (13)
|
(14) |
Совместное решение уравнений приводит к квадратному уравнению:
*,('-*) (а-сх)
Кг*
6) — Ьгх
|
(15) |
Если bi =• 0 (растворимость МА постоянна) и а = с, то
1КС + КгЬ 1 - VKJi {Ktbi + 4К, С)
На рис. 174 нанесена кривая 3 степени перехода для а = с, Ь ~ 0,05с и /Сг = Ю-7. При травке монохроматного щелока плавиковой кислотой можно принять К = Ю-3 и Ь{ — 0,05с, при этом уравнение (15) даст х = 0,998.
|
/С2 = При Ь2 = 0 Откуда |
Если травку производят малорастворимой кислотой (например угольной), то можно принять [НА] = const:
[Н+] [СгС>4~] кх [НА] [СгО2-] _ К, [НА] (1 - х) [HCrOj] = [А-] [НСЮ7] = (6, + Ь? х) х
Г К [НА] (1 — *)
Ьх Кх [НА]
Кх [НА] + КгЬ{
Пока насыщение раствора солью МА еще не достигнуто, можно принять:
[А-] + [НСг04-] = сх
Тогда
/С, [НА] (1-х)
*2= г?-----------------------------
- /С, [НА] + Ук [НА]2 + 4К, К2с [НА] ------- = m (17)
Если применяемая для травки кислота (или ангидрид) газоОбразна, то в результате наличия равновесия
[НА]газ [HAjp. p
На степень перехода должно влиять давление. Если для первого приближения допустить, что система подчиняется закону Генри, то
[НА] - Кр
Где р — парциальное давление кислоты или ее ангидрида в газовой фазе.
Подставив это значение [НА] в уравнения (16) и (17), можно найти зависимость х от давления. При наличии МА в твердой фазе
|
(18) (19) (20) |
„ KiKp
ККр + КгЬ При отсутствии МА в твердой фазе
- КХКр + Укк2р2 + 4/с, * Ж*с
|
1 + |
Из уравнения (18) следует
Ktbj ККр
Откуда видно, что с повышением давления степень перехода монохромата в бихромат растет.
Влияние температуры сказывается, главным образом, на измели
Нении растворимости НА и МА, так как отношение можно принять не зависящим от температуры. Вследствие того, что растворимость газов сильно уменьшается с повышением температуры, а растворимость солей обычно увеличивается, то, как видно из Уравнения (20), степень перехода с повышением температуры должна уменьшаться.
Когда все компоненты хорошо растворимы, степень перехода х, Как мы видели выше, не зависит от концентрации. Иначе обстоит дело при малорастворимой кислоте. Так как Ь сильно уменьшается
* ростом концентрации (bi = то, как видно из уравнения (18),
значение х должно существенно повышаться с ростом концентрации при наличии МА в твердой фазе (изменением [НА] с концентрацией можно пренебречь). Наоборот, при отсутствии МА в твердой фазе величина х уменьшается с ростом концентрации, как это видно из уравнения (19).
Что касается влияния «силы» травящей кислоты, то на рис. 162 видно, что с уменьшением константы диссоциации кислоты до К = 10~4 степень перехода снижается с 1 до 0,97—0,99; при К = Ю-5 х = 0,91 — 0,97; с дальнейшим снижением К до 10-9 значение х падает по S-образной кривой до 0,09—0,2 и асимптотически приближается к нулю.