Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Способ Гаргривса-Робинзона
По этому способу50 сульфат натрия и малоконцентрированный хлористый водород (8—10% НС1) получают из поваренной соли, содержащей ~0,2% окиси железа, являющейся катализатором, по суммарной реакции:
4NaCl (тв.).+ 2HsO (г.) + 2SOs (г.) + 02 (г.) = 2NasS04 (тв.) + 4НС1 (г.) + 99 ккал
В начале XX в. этот способ довольно широко применяли в Западной Европе, особенно в Англии. По этому способу увлажненную noBapeHHvio соль с добавкой небольшого количества сульфата железа и глины прессуют для получения пористых брикетов с соломой и опилками. Последние потом выгорают, образуя пористую массу. Просушенные брикеты загружают в несколько чугунных котлов — камер, имеющих высоту 4—5 м, диаметр 5—6 м и Емкость 50 т каждая, обогреваемых снаружи топочными газами. Через камеры последовательно проходит смесь сернистого газа с воздухом и водяным паром. Реакционная масса прогревается до» 350°, затем начинается выделение тепла экзотермической реакции и дальше процесс протекает самостоятельно. Процесс ведется при оптимальной температуре в наиболее горячей зоне около 540° и Проходит очень медленно — в течение 15—20 суток; выход сульфата достигает 90—97%. Значительного повышения температуры сверх оптимальной не допускают, так как уже при 640° в системе NaCl—Na2SC>4 появляется эвтектический расплав, содержащий 32,6% NaCl. Корка спекшейся массы вокруг расплава препятствует проникновению газов к непрореагировавшей соли и в этом случае из камеры вместе с сульфатом натрия выгружают глыбы, содержащие много NaCl. Периодически из камер выгружается сульфат и они вновь загружаются брикетами соли. При этом осуществляется противоток — свежая газовая смесь поступает в камеру с наиболее отработанной массой и выходит из вновь загруженной камеры.
Процесс очень громоздок. Экономичность этого способа определялась дешевизной сырья — использованием больших количеств отбросных сернистых газов медеплавильных и других металлургических заводов. В настоящее время этот способ почти не
Применяется. В некоторых случаях его испольвуют для получения сульфата калия В1.
Раньше считали52, что образование сульфата натрия при суль - Фатизации хлористого натрия влажной смесью сернистого газа С воздухом идет через сульфит натрия
502 + Н20 + 2NaCl = Na2S03 + 2НС1
Быстро окисляющийся кислородом воздуха в сульфат, и предполагали, что образование сульфита лимитирует общую скорость процесса. Позднее было доказано53, что вначале происходит окисление SO2 в SO3, который переводит хлорид в сульфат:
503 + Н20 + 2NaCl = Na2S04 + 2НС1
Это позволяет значительно интенсифицировать процесс путем добавки к поваренной соли катализаторов, ускоряющих окисление S02. Лучшим катализатором в этих условиях является окись железа. Так, добавка к NaCl 1% колчеданного огарка сокращает длительность процесса с 15—20 суток до 1—1,5 ч при 95—96%-ном выходе сульфата натрия. Проведение процесса с увеличенным количеством катализатора позволяет значительно рационализировать старый способ, заменив громоздкую аппаратуру более производительной. В условиях СССР, располагающего большими количествами отбросных сернистых газов, такой модернизованный •способ может оказаться экономичным для получения сульфата калия, являющегося ценным удобрением, качество которого не снижается от содержания в нем небольших количеств соединений железа.
Этот процесс может быть осуществлен в печи со взвешенным •слоем. Горячие газы, содержащие S02, 02 и Н20, пропускают через слой хлорида со скоростью 0,3—1,5 м/сек, достаточной для уноса частиц образующегося сульфата калия. Уносимую сульфатную пыль отделяют от газа, содержащего НС1, до его охлаждения, я часть газа возвращают в нижнюю зону печи. При 600° степень превращения КС1 в K2SO4 достигает 98% 54,65. Может представить ■интерес и видоизменение этого процесса при осуществлении его в отсутствие водяного пара
2КС1 + S02 + 02 - K2S04 + С12 С получением хлора или хлористого сульфурила5в.
Синтез хлористого водорода из элементов
Синтез из элементов дает концентрированный хлористоводородный газ, содержащий 80—90% и больше НС1, легко поддающийся сжижению, а поглощение его дистиллированной водой позволяет получать чистую реактивную кислоту, концентрация котоРой при необходимости может достигать 38% в7-90. Реакция взаимодействия хлора с водородом 50
Н2 + Cl2 2НС1 + 44 ккал
Обратима. Константа равновесия реакции ^ „2
„ Р HC1
Ар = -
Рн2 ' Pci2
(гдер — парциальные давления компонентов) вычисляется по уравнению
95R4
Lg Кр - -^у1 - 0,533 Lg Т 4- 2,42
Где Т—абсолютная температура. По другим данным91:
Igtfp--^-0,44 Lg 7"+ 2,16
Обозначив через х долю диссоциированного НС1, получим для константы равновесия реакции выражение
К - 4(1— Х)2
С помощью которого вычислены следующие значения х
T, °с х T, °с *
17» 2,51 - КГ'7 1227 6,10- 10""'
.427 1,12- 10 7 1727 0,41 • Ю-2
727 1,34-10 2227 1,30-Ю-2
Таким образом, распад НС1 на элементы становится заметным лишь при очень высоких температурах — выше 1500°.
Теплота реакции синтеза, равная при 0° 44 ккал, несколько увеличивается с повышением температуры:
. <7^= 44 + 0,0011^ ккал
При адиабатическом сгорании стехиометрической смеси хлора и водорода, имеющей температуру 0°, теоретическая температура факела пламени равна ~2500°. Практически, вследствие некоторой диссоциации НС1, температура пламени снижается примерно до 2400°. Избыток в газовой смеси одного из компонентов — хлора или водорода — еще несколько понижает температуру горения.
При обычной температуре, в отсутствие сильных световых лучей, реакция образования НС1 из элементов идет очень медленно. При нагревании смеси хлора и водорода или под действием яркого света происходит взрыв вследствие цепной реакции92: Cl2 + /zv = Cl + Cl;. С1+Н2 = НС1+Н; H + CI2 = HC1 + C1; С1 + Н2 = НС1 + Н н т. д.
Цепная реакция могла бы прерваться в результате таких реакций: Н + CI = НС1; CI + CI = С12; Н + Н = Н2. Однако вероятность этих реакций очень мала, так как концентрация атомов ничтожно мала по сравнению с концентрацией молекул.
Присутствие кислорода замедляет соединение хлора с водородом. По-видимому, имеет место обрыв цепи реакций вследствие соединения кислорода с атомарным водородом63. Скорость реакции обратно пропорциональна концентрации кислорода в газовой смеси; в отсутствие кислорода реакция практически протекает мгновенно. Зависимость скорости фотохимической реакции от концентрации компонентов может быть выражена эмпирической формулой Тона
D. [НС1] [С12]2 [Н2]
Dr =Л ' [02]{[Н2]+0,1 [С12]}
Где К — константа скорости реакции, зависящая от. интенсивности возбуждающего светового луча' или теплового импульса.
Реакции, возбуждаемые световым или тепловым импульсом, но скорость протекания которых в дальнейшем, в отличие от чисто фотохимических реакций, зависит от температуры, называются темновыми.
Считают, что определяющей стадией рассматриваемого тем- нового процесса является реакция CI + Н2 = НС1 + Н. Если обозначить константу скорости этой реакции Кь а константу диссоциации молекул хлора /Ср, то константа скорости образования НС1, равная /С = '/2/Ср •/Сь может быть вычислена по эмпирической формуле64:
35 370
Скорость реакции зависит также от присутствия катализаторов — влаги, твердых пористых тел (губчатой платины, древесного угля) и некоторых минеральных веществ (кварца, глины и т. п.). Абсолютно сухие хлор и водород не взаимодействуют между собой. Присутствие следов влаги ускоряет реакцию столь интенсивно, что она может произойти со взрывом. Повышение содержания влаги сверх 5- Ю-6 уже не отражается на скорости реакции.
В производственных установках осуществляется спокойное, не взрывное горение водорода в токе хлора. Водород подается с избытком 5—10%, что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту. Возможно, однако, вести процесс и при подаче стехиометрических количеств водорода и хлора или очень малого избытка водорода (до 1 %); при этом получаемый хлористый водород содержит до 1% С12 и 2% Н2. Очистку газа от хлора можно осуществить, пропуская его через активированный уголь при 450° с объемной ско-
|
ТАБЛИЦА 33 Пределы взрывных концентраций водорода в газовых смесях (в объемн. %)
|
Ростью 260 мг/ч на 1 ж3 угля65. Избыток водорода выше 20% Опасен, так как может привести к взрыву в процессе абсорбции НС1 вследствие образования гремучей смеси. В табл. 33 приведены пределы взры- ваемости смесей водорода с хлором, кислородом и с воздухом (при исходном общем давлении 0,5—1,5 ат) 66.
Температура самовоспламенения смеси хлора с водородом в воздухе равна 240°.
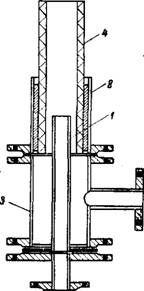
Сжигание смеси хлора и водорода производится в печах различных конструкций, представляющих собой небольшие камеры из огнеупорного кирпича, плавленого кварца, графита или из металла. Неотъемлемой частью печей являются горелки для сжигания водорода в токе хлора. Устройство горелки показано на рис. 117. Она состоит из двух стальных трубок, вмонтированных в стальной патрон. Хлор подается по внутренней трубке, водород — по наружной. В наружной трубке горелки укреплен жаростойкий динасовый наконечник 4. Газы, сгорающие в горелке, образуют длинный факел пламени, температура которого понижается по длине печи от 1800—2000° до 800—1200°. Регулировка подачи газов производится с помощью ротаметров или шайб с дифференциальными манометрами и контролируется по анализу отходящего газа.
|
Рис. 117. Горелка: / — трубка для ввода хлора; 2 — трубка для ввода водорода; 3 —патрон; 4 — динасовый наконечник. |
Простейшими печами являются полые кирпичные камеры, футерованные внутри огнеупорным кирпичом. При внутренних размерах камеры: ширина 0,61 м, длина 2,16 м, высота 0,71 м, объем ее составляет 0,94 м3 и производительность — от 3,5 до 7,5 т соляной
кислоты в сутки. Иногда реакционные камеры таких печей заполняются контактным материалом — графитом, коксом, кварцем, огнеупорной глиной и т. п.
Несколько большее распространение получили вертикальные печи, монтируемые из кварцевых труб. Кирпичные и кварцевые печи работают под небольшим вакуумом во избежание проникновения хлористого водорода в атмосферу цеха. Недостатком этих печей является отсутствие условий для хорошего отвода тепла, вследствие чего газ уходит из них с очень высокой температурой.
Наиболее совершенными являются печи, построенные из специальных или простых сталей, которые достаточно устойчивы, несмотря на содержание в хлористоводородном газе влаги, так как температура газа выше точки росы. Металлические печи устраиваются, как и кварцевые, в форме вертикальных труб, но обладают значительно большей производительностью 1 м3 объема, так как отвод реакционного тепла из них через наружные стенки идет во много раз интенсивнее, чем через стенки печей из силикатных материалов. В ряде случаев стальные печи снабжаются снаружи водяными кожухами и охлаждаются проточной водой. Это позволяет дать на них значительно большую нагрузку. Стальная печь при диаметре 0,25 м и высоте 2,5 м дает от 6 до 25 т соляной кислоты в сутки (в зависимости от способа отвода тепла). Кроме того, стальные печи могут работать под давлением, что увеличивает концентрацию НС1 в газе, вследствие устранения подсосов воздуха59. При водяном охлаждении температура воды в кожухе стальной печи не должна быть ниже 90—95°, т. е. ниже точки росы газа, во избежание конденсации из него влаги на стенке печи 67-69. Выходящий газ обычно име^т температуру не ниже 400°. При содержании в газе ~5% влаги не следует допускать дальнейшее его охлаждение в отводных железных трубах ниже 200°. При необходимости охлаждать газ до 30—60° его транспортируют но трубам из пропитанного фенольной смолой графита. При необходимости получить сухой хлористоводородный газ его сушат в стальной насадочной колонне концентрированной серной кислотой, причем он охлаждается до ~250°59.
Опубликованы патенты, предусматривающие использование подаваемого в печь избыточного водорода из отбросного газа после абсорбции НС1, путем инжектирования этого газа свежим водородом в добавочную печь70.
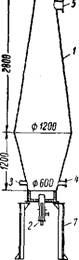
В СССР применяют двухконусные печи с естественным воздушным охлаждением (рис. 118). Благодаря тому, что форма печи близка к форме факела пламени, обеспечивается равномерная тепловая нагрузка стенок печи. Корпус печи сварен из 8-миллиметровой листовой стали (Ст. 3). Нижняя цилиндрическая часть корпуса и съемное днище футерованы огнеупорным кирпичом.
Верхний конец печи прикрыт зажатой между фланцами предохранительной мембраной из листа паранита или асбеста, которая выталкивается в случае внезапного взрыва газовой смеси.
Водород, освобожденный от влаги охлаждением его до 25— 30°, последовательно проходит гравийный пламягаситель, водоотделитель, гравийный искрогаситель, обратный клапан и поступает в печь. Скорость подачи газов в печь составляет, в зависимости от нагрузки, 40—120 мГ/ч хлора и 43—130 мъ! ч водорода, что почти в 1,5 раза выше скоростей газовых потоков в цилиндрической печи. Давление хлора и водорода в подводящих трубопроводах должно быть не меньше 800 мм рт. ст. В печи поддерживают давление около 600 мм вод. ст. Температура наружной стенки печи достигает 400°, а температура отходящего газа в газопроводе перед абсорбционной колонной (см. ниже) должна быть не больше 250°. Автоматическая регулировка подачи газов обеспечивает нужное соотношение между хлором и водородом, поступающими в горелку. Помимо этого, процесс контролируют по цвету пламени, который должен быть молочно-белым. В случае избытка хлора, что недопустимо, цвет пламени приобретает зеленоватый оттенок, при большом избытке водорода — голубой.
|
ФЩ/6 |
|
Рис. 118. Схема стельной печи для синтеза хлористого водорода: |
|
1 — корпус печи; 2 — го >елка; 3 — за-. пальный лкзк; 4 — смотровым штуцер с кварцевым стеклом; 5— шт цер для отвода >лэристого водорода, 6 — пре - дохР? нителы}ый лист: 7 — опорная к - нструкция. |
Технические газы, используемые для синтеза НС1, должны быть по возможности чистыми. Концентрация водорода не должна быть ниже 95%, а концентрация хлора — не ниже 90%. В получаемом хлористоводородном газе содержание НС1 не должно быть меньше 80%. Производительность описанной печи достигает 10 т 100%-ного хлористого водорода в сутки. Расход газов на 1 т 31%-ной соляной кислоты составляет: хлора (100%-ного) 0,305—0,312 г; водорода (100%-ного) 110—112 ж3; расход электроэнергии 35 квт-ч, воды 20 м пара 0,014 мгкал.
Представляет интерес осуществление синтеза НС1 из элементов в графитовой горелке, погруженной в соляную кислоту, находящуюся в стальном 'резервуаре, футерованном кислотоупорным Кирпичом по слою резины. Температуру кислоты поддерживают несколько ниже равновесной, соответствующей кипению кислоты при данном парциальном давлении НС1 в газе. Тёплота горения и растворения отводится путем циркуляции кислоты через во? Дуцгой холодильник. Непрореагировавшие водород и хлор перед
13 М. Е. Позин
отводом из аппарата разбавляют воздухом во избежание образования взрывчатой смеси. Недостатком этого способа является большой расход воды на охлаждение кислоты[14].
|
Юо |
|
|
|
If 60 |
|
400 500 Температура, 'С |
|
= 40 |
|
600 |
|
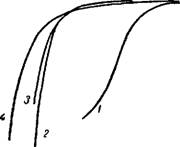
200 300 |
|
Рис. 119. Зависимость степени превращения С12 в НС1 от температуры: У - древесный уголь; 2 —кокс; 3 — древесный уголь с примесью окиси железа; 4— активированный уголь. |