Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
СОЛИ СУЛЬФИДНОГО РЯДА
К солям сульфидного ряда относятся производные сероводорода (сульфиды), полисернистых водород ов (полисульфиды), а также оксисульфиды типа RO • RS. Они широко распространены в природе и являются сырьем для получения цветных металлов и серной кислоты. К ним относятся сульфиды меди, свинца, серебра, цинка, никеля, кобальта, железа, мышьяка, сурьмы, ртути и др. Природные сульфиды не растворимы в воде. Важнейшими сульфидными продуктами, получаемыми заводскими способами или образующимися при очистке промышленных газов от сероводорода, являются растворимые соединения щелочных металлов. В этой главе рассматриваются производства сернистого натрия, гидросульфида натрия и некоторых полисульфидов.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Сернистый натрий Na2S В безводном состоянии имеет плотность 1,86 г/см3, плавится при 1180°2. Сильно гигроскопичен. Насыщенный водный раствор содержит при 18° 15,3%, при 90° 36,4% Na2S. Из водных растворов ниже 48° кристаллизуется Na2S • 9Н20, выше 48° — Na2S • 6Н20. Водные растворы имеют сильно щелочную реакцию вследствие гидролиза:
Na2S + H20 NaOH + NaHS
В 0,1 н. растворе при 25° степень гидролиза Na2S Составляет 86,5%- Дальнейший гидролиз по схеме NaHS + H2O^NaOH + H2S Практически не идет; в 0,1 н. растворе при 25° NaHS Гидролизуется лишь на 0,12%.
Гидросульфид (сульфгидрат) натрия NaHS Устойчив только в растворах. Кислород воздуха медленно окисляет эти растворы, вероятно, по следующей схеме3:
HS~ + 02 = HSOJ; 2HSOJ = S20|~ + Н20; 2HSO2-f 02 = 2HS0J
Образование тиосульфата идет быстрее, чем сульфита, поэтому главным продуктом окисления является тиосульфат. Кроме того, продуктами окисления являются также сульфат и полисульфиды. Сульфид натрия окисляется медленнее гидросульфида; механизм его окисления сложнее — помимо тиосульфата, сульфита и сульфата образуются политионовые кислоты, преимущественно тритио- новая (см. гл. XIV). При нагревании растворов NaHS Переходит В Na2S И выделяется сероводород:
2NaHS Na2S + H2S
Растворимость NaHS В воде при 20° равна 42% 4.
Сульфид аммония устойчив при температуре ниже —15°, вышь Этой температуры разлагается:
(NH4)2S = NH3 + NH4HS
Поэтому при взаимодействии газообразных NH3 И H2S Без охлаждения образуется гидросульфид аммония, устойчивый до ~32°. Давление диссоциации твердого NH4HS (с выделением эквимолекулярной смеси NH3 И H2S) Равно:
Температура, °С.......................... 4,2 9,5 22 25 32,0 >44,4
Давление, мм рт. ст..................... 132 175 410 501 772 1560
О системе NH3—H2S—Н20 см.'5>6, а о получении (NH4)2S См.7.
Гидросульфиды натрия или калия образуются при поглощении сероводорода 8 из промышленных или природных газов водными растворами почти всех применяемых поглотителей — карбонатов, фосфатов, фенолятов натрия или калия, солей аминокислот (например, диметиламиноуксусного калия):
Na2C03 + H2S NaHC03 + NaHS K3P04 + H2S 5=± K2HP04 + KHS C6H5ONa + H2S C6H5OH + NaHS (CH3)2NCH2C00K + H2S (CH3)2NCH2COOH +KHS
При регенерации растворов выделяется сероводород, который Может быть использован.
При поглощении сероводорода водными растворами идут слеДующие равновесные процессы:
H2S (г.) H2S (раств.) Н+ + HS"
Левое из этих равновесий зависит от парциального давления H2S В газе и от температуры, а правое, также зависящее от температуры, устанавливается в соответствии с константой диссоциа-
Ции ^~ ^[H2S]S ^ ' При 25° ^=1.2-Ю-7. Для хорошего поглощения сероводорода нужно, чтобы концентрация H2S В растворе била малой, что достигается при значительной диссоциации, когда
Отношение [HS~]: [H2S] Велико. Это осуществляется в растворе с малой концентрацией ионов Н+. Если, например [HS~] : [H2S] = = К '• [Н+] = 100, то [Н+] = 1,2 • 10~9, что соответствует значению рН«*9. Приблизительно такой порядок значений рН и имеют растворы упомянутых выше поглотителей. Еще лучшими поглотителями были бы растворы с большими значениями рН, однако по этой же причине регенерация таких растворов с выделением поглощенного сероводорода была бы затруднена. Хорошо поглощают сероводород и легко отдают его при регенерации вещества, для реакции которых с H2S Изменение изобарного потенциала AZ2% Находится в пределах от +15 до —1 9.
Константы равновесия для систем H2S—К2СО3—КНС03— KHS—Н20 (I) и H2S—Na2C03—NaHC03—NaHS—H20 (II) При 25° L0>11:
_ [КНСОзНКШ] _ 4----------------- Г-мол
{KiCOsJ PH2S Л • мм рт. Дт.
_ [NaHCOJINaHS]- _ г-жол
[Na2C03]PH2S л-мм рт. ст.
Их зависимость от температуры в пределах 25—60°:
, „ 2800 00 . „ 2500
* Kl - 4^76f " 3,2; = 1ЩТ ~ 3'1в
Равновесное давление сероводорода над раствором для этих систем:
,4s = 0,714 (/+43) С2,88 и PH2s = 5,4 + 48) С3'04
Где С — концентрация раствора, н.
Полисульфидными называются соединения типа M2S„ Или M2S • S„_I, Так как предполагается, что атомы серы здесь связаны с сульфидом. В водных растворах полисульфиды гидролизуются 12, найример:
2 (S • S4)2" + 6Н20 = 2S20|" + 6H2S
Способность к гидролизу понижается с уменьшением числа атомов серы в молекуле полисульфида, вероятно вследствие уменьшения при этом степени диссоциации13. Полисульфиды в твердом виде сильно гигроскопичны и во влажном воздухе окисляются с выделением свободной серы
S2-+I,502=S2023- + Sn_2
И Далее
S2O§-+'/2O2 = Sor + S
В присутствии двуокиси углерода полисульфиды наряду с сеРой выделяют также сероводород:
S2~ + С02 + Н20 = СО|- + H2S + S„_,
Полисульфиды образуются при взаимодействии сульфидов с серой, а также при медленном окислении кислородом воздуха гид - ро'сульфидных растворов, например:
4MHS + 02 = 2Н20 + 2M2S2
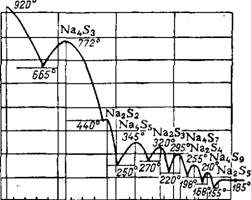
Для натрия известны полисульфиды с числом атомов серы до п = 5. Как видно из рис. 142, в системе NagS—S .полисульфиды мо-
Na2S _ 900
800
W0
| 500
I
S- 500
£ ш
|
200 |
300
Гут существовать до 920° (по новейшим данным2 до 1180°); выше этой температуры существует только моносульфид натрия. Для. калия известны полисульфиды с числом атомов серы до 6. Поли - сульфиды кальция менее устойчивы, чем полисульфиды натрия и калия и сохраняются лучше всего в растворах, но известны и су - хие препараты полисульфидов кальция. Еще менее стабильны полисульфиды аммония.
ПРИМЕНЕНИЕ
|
100------------------------------------------ —---------------------------------------------------------------- - ЬО 50 60 70 ВО Сера. Sec. % Рис. 14^, Система Na2S—S. |
Сульфид натрия служит сырьем для производства сернистых красителей, применяется в текстильной промышленности при крашении этими красителями хлопчатобумажных тканей, в кожевенной промышленности для удаления волоса со шкур, в производстве красок. Его используют также для получения тиосульфата и гидросульфида натрия и во флотационных, процессах, в частности при флотации цинковой обманки и руд, содержащих железо, цинк и
Свинец. Описаны опыты по замене сульфидом натрия едкого натра при химической обработке глинистых растворов для выщелачивания гуминовых веществ из бурых углей14. Сульфид натрия является полупродуктом в некоторых способах получения соды и едкого натоа из сульфата натрия.
Технический сернистый натрий выпускают в виде плавленого продукта в железных барабанах или в чешуированном виде в полиэтиленовых мешках, вложенных в бумажные. Согласно ГОСТ ■596—70, он должен содержать (в %):
Высший 1-й 2-й
Сорт сорт сорт
Сернистого натрия (Na2S), не менее ... 70 66 63 Не растворимых в воде веществ, не более 0,2 0.5 1,5
Железа (Fe), не более.......................................... 0,08 0,15 0,45
Гидросульфид натрия применяют главным образом в производстве искусственного шелка, а также в кожевенной промышленности. Его выпускают в виде раствора, содержащего 22% NaHS И не более 3% Na2S И транспортируют в стальных цистернах, контейнерах и бочках.
Полисульфиды также используют в кожевенной промышленности и при флотации руд и особенно в качестве средств борьбы ■с вредителями растений 15>16. Наиболее распространенным полисульфидным инсектофунгицидом является известково-серный отвар, содержащий полисульфиды кальция; реже применяются полисульфиды натрия или калия, называемые иногда серной печенью, а также аммония и бария, б том числе и сольбар (стр. 421). Токсичность полисульфидов объясняется действием свободной серы, выделяющейся при разложении препаратов на воздухе. Полисульфиды натрия нашли также широкое применение в производстве полимеров, используемых для получения полисульфидных кау - чуков (резинит, тионол и др.).