Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
СОЕДИНЕНИЯ МАРГАНЦА
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Марганец образует ряд окислов: закись МпО, окись Мп20з, двуокись Мп02, марганцоватистый ангидрид Mn2Os [1], марганцовистый ангидрид МпОз * и марганцовый ангидрид Мп207. Окислы и гидроокислы марганца 1 являются важнейшими марганцовыми минералами (табл. 61).
ТАБЛИЦА 51
Природные кислородные соединения марганца
|
Минерал |
Химическая формула |
Плотность [2] |
|
Пиролюзит и полианит или рамс- |
Мп02 (Р и у) |
4,75—5 |
|
Деллит |
||
|
Вернадит |
Мп02 • пН20 |
3,0—3,2 |
|
Курнакит или браунит |
Мп203 (а и Р) |
4,7—4,9 |
|
3 (Мп, Fe)203-Mn8i0, |
||
|
Манганит и гроутит |
Мп203 • Н20 (а и Р) |
4,2—4,4 |
|
Манганозит |
МпО |
|
|
Пирохроит и бекстремит |
МпО • Н20 (а и Р) |
|
|
Родохрозит или марганцовый шпат |
МпС03 |
3,4-3,6 |
|
Родонит |
MnSi03 |
3,5—3,7 |
|
Гаусманит |
Мп304(а, Р и у) |
4,7—4,9 |
|
Гидрогаусмаиит |
Мп304 • пН20 (а и Р) |
|
|
Биксбиит |
(Мп, Fe)203 |
|
|
Псиломеланы или воды |
;cRO • г/Мп02 • гН20, где R—Мп, К2. Ва, Са и др. |
2,3-4,7 |
В состав природного пиролюзита входит 1—3% воды; полианит безводен. Пиролюзит растворяется в соляной кислоте с выделением
Хлора и в серной кислоте в присутствии восстановителя, а также В сернистой кислоте; азотная кислота взаимодействует с пиролю - 4 зитом медленно. Природный манганит не разлагается азотной и разбавленной серной кислотами, но медленно растворяется в сернистой кислоте; искусственно приготовленный Мп203-Н20 разлагается разбавленными кислотами. Гаусманит реагирует с минеральными кислотами, образуя смесь солей двух - и трехвалентного марганца. Браунит представляет собой марганцовую соль мета - марганцоватистой кислоты МпО (ОН) 2, имеющую структурную
Формулу 0=Мп Мп. Вследствие присутствия изоморфного
MnSi03 в минерале содержится до 15% SiC>2.
Псиломелан относится к гелеобразным марганцовым рудам неопределенного состава. Его можно рассматривать как твердые растворы манганита, пиролюзита, полианита и, возможно, других окислов марганца друг в друге и воды в них, содержащие также соли метамарганцоватистой МпО(ОН)2 и ортомарганцоватистой Мп(ОН)4 кислот. По химическим свойствам он аналогичен водной двуокиси марганца, быстро растворяется в сернистой кислоте. Содержит 60—80% Мп02, 8—25% МпО, 3—4% Н20. Псиломеланы имеют разные названия в зависимости от преобладающего состава входящей в минерал группы RO: псиломелан (МпО), криптомелан (К2О), рансьеит (СаО), романешит (ВаО) и т. д.
Родохрозит или марганцовый шпат МпСОз, имеющий окраску от розовой до красной, встречается обычно в изоморфных смесях С карбонатами кальция, магния, железа, кобальта, цинка и в смеси с Мп8Юз; основному минералу сопутствуют продукты его разложения— пиролюзит, псиломелан и др. Разложение синтетического карбоната марганца при нагревании с образованием МпО может быть обнаружено при 70°, со значительной скоростью он разлагается при 200—300°2, а равновесное давление С02, равное 1 ат, Достигается при 632°. Значения этих температур различны для разных образцов природного минерала. При 200 — 300° в токе воздуха МпСОз окисляется последовательно до Мп3(04, Мп203 и Мп02.
Закись марганца МпО — основной окисел серо-зеленого цвета, <пл=1785°, на воздухе окисляется, при растворении в кислотах образует соли двухвалентного марганца слабо-розовой окраски. Розовая окраска кристаллогидратов и растворов солей Мп2+ обусловлена ионом [Мп(Н20)4]2+. Безводный сульфат марганца MnS04 бесцветен, с водой образует стабильные и метастабильные кристаллогидраты с 1, 4 (только метастабильный), 5 и 7 молекулами воды3. Полностью обезвоживается выше 280°; безводный плавится при 700°. Термически более устойчив, чем сульфаты Fe, Со, Ni. По другим данным4, MnS04-5H20 при нагревании одновременно с по
терей последней молекулы воды' окисляется кислородом воздуха с образованием Mn20(S04)2. С повышением температуры растворимость MnS04 в воде уменьшается: насыщенный водный раствор содержит при 10°-37,4%, при 60°-35,2%, при 100° —26,5% MnS04; выше 200° она приближается к нулю. Хлорид марганца ниже 58° кристаллизуется из водного раствора в форме МпС12 • 4Н20, выше этой температуры МпС12 ■ 2Н20; насыщенный раствор содержит при 25° — 43,6%, при 100° —53,7% МпС12. При нагревании тетрагидрат хлорида марганца теряет пер - * вую молекулу воды при 120°, | вторую — при 150°, а две по - 5 следние—при 220°; полное обезвоживание сопровож - jjf дается незначительным гидролизом (1—1,5%)5 • МпС12 разлагается перегретым водяным паром на МпОиНС1 при 350—450°, с кислородом начинает реагировать при 500°; ниже температуры плавления (650°) водородом практически не восстанавливается. Нитрат марганца кристаллизуется в виде
Mn(N03)2 • 6Н20 ниже 24°, а выше этой температуры Mn(N03)2- • ЗН20; в насыщенном растворе при 0° — 50,5%, при 35,5 — 76,8% Mn(N03)2. Растворимость в воде двойной соли NH4MnP04 • Н20 При 20° с уменьшением рН от 8,0 до 4,0 увеличивается от 1,43- 10~i до 7,99-Ю-4 г-мол/лб. Из растворов солей Мп2+ Мп(ОН)2 осаждается при рН = 8,7.
Окись марганца Мп20з бурого цвета, обладает слабоосновными свойствами. Соли трехвалентного марганца в растворах устойчивы лишь в присутствии свободных кислот; гидролизуясь, они дают осадок гидратированной окиси марганца или соли двухвалентного марганца и гидратированную двуокись марганца.
|
200 SOD |
|
1000 1300 Температура, "С |
|
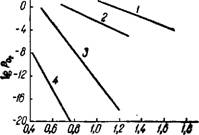
Рис. 206. Изобара диссоциации Мп02. |
Двуокись марганца Мп02 — амфотерный окисел; она образует с кислотами соли четырехвалентного марганца, легко разлагающиеся водой с выделением гидратированной двуокиси марганца, а как кислотный окисел — соли марганцоватистой кислоты, манга - ниты. Двуокись марганца7 представляет собой мелкокристаллическое вещество черного цвета, не растворимое в воде. В зависимости от способа образования Мп02 существует в различных модификациях, отличающихся физическими свойствами. При нагревании Мп02 отщепляет кислород и переходит последовательно в окись марганца Мп203, Мп304 и, наконец, й закись марганца МпО.
Температуры перехода Мп02 в Мп203 несколько различны для разных модификаций Мп02. Однако общий вид изобары диссоциации мало меняется и остается подобным, изображенному на рис. 206. Переход Мп02 в Мп203 и другие окислы происходит с образованием твердых растворов окислов. Выше 1350° существует только МпО.
Термический распад пиролюзита и манганита может быть представлен схемами8:
560° 940° 1180° Р-Мп02 > Р-Мп2Оэ ----------------- > Р-Мп304 > У"Мп304
Пиролюзит Р-Брауннт Гаусмаиит Гаусмаиит
260° 600° 940°
МпО • ОН ------- > а-Мп203 (—► Мп02) —^ р-Мп203 -------------------- > р-Мп304
Манганит а-Браунит Пиролюзит 0-Врауиит Гаусмаинт
На рис. 207 приведены значения равновесных давлений диссоциации (^р0)для окислов марганца1'9 (см. также10-12). Линии/,
2, 3 и 4 делят диаграмму на поля устойчивости отдельных фаз — металлического марганца, закиси марганца, гаусманита, трехокиси марганца и двуокиси марганца.
Соединения шести- и семивалентного марганца обладают кислотными свойствами. Они образуют, соответственно, марганцови - стокислые соли — манганаты и марганцовокислые соли—перман - ганаты. Марганцовистая кислота Н2Мп04 неустойчива и распадается на марганцовую кислоту НМп04 и Мп02. Манганаты в кислых растворах разлагаются с образованием соединений четырех - и семивалентного марганца — в осадок выделяется двуокись марганца, а в растворе образуется перманганат. Пер - манганат калия КМп04 представляет собой темно-пурпуровые с фиолетовым оттенком, почти черные кристаллы ромбической формы. Насыщенный водный раствор содержит при 0° —2,75%, при 20° —6%, при 65° —20,0% КМп04. При охлаждении растворов NaMn04 с концентрацией, меньшей 41,4%, кристаллизуется лед, в пределах концентраций 41,4— 75,2% — NaMn04-3H20 с /пл = 68,7°13. В щелочных растворах перманганат разлагается
|
*4
Uo3 • / Рис. 207. Зависимость Lg PQj От |
|
■уг при диссоциации окислов марГанца. По реакциям: 1 - 2Мп02 - Мп203 + '/а Оо - ЗМп203 - 2Мп304 + Ч, б2 - Мп304 = ЗМпО + Vs 02 4 — МпО= Мп + '/j 02. |
4МпО^ + 40 Н~ = 4Мп02- + 2Н20 + 02
Причем разложение может идти и глубже. Соединения с ионами Мп04~ имеют зеленую окраску. Начальная скорость восстановления перманганата калия концентрированными растворами КОН (0,9—13,8 М) при 18° очень велика, затем скорость реакции уменьшается и стремится к нулю в области степеней окисления, соответствующих четырех-, пятивалентному марганцу. В этой области реакцию ускоряют свет и ультрафиолетовые лучи, кислород замедляет ее. Предполагают14", что восстановление КМПО4 проходит через три стадии:
МпО; + ОН = MnOf- + Н+ + О
МпО|~ + ОН" = MnOf + ОН |
} более медленно
МпО^~ + 0Н = Мп03_ + Н* + 0 J
Переход Ш034~ в Мл02
При малых концентрациях КОН возможны реакции распада ионов:
2MnO®~ + 2Н20 MnO^~ + Мп02 + 40Н" (~ Ш КОН) ЗМпО2- 4- 2Н20 2MnOJ + Mn02 + 40Н~ (~0,0Ш КОН)
Восстановление ионами гидроксила Мп7+->-Мп6+ (при 0 и 20°) и Мп6+ -> Мп5+ (при —10 и 0°) является процессом половинного порядка, а дальнейший процесс Мп5+ -> Мп4+ (при 20—30°) первого порядка. Энергии активации этих процессов равны соответственно 9,3; 11,2 и 23 ккал/моль 15.
При нагревании выше 200° КМп04 разлагается с потерей кислорода по реакции:
2КМп04 = К2Мп04 + МпО.2 + 02
А также по реакции 12:
3KMn04 = К3Мп04 + 2Мп02 + 202
Термическое разложение быстро ускоряется с повышением температуры и в присутствии металлического алюминия. Так, при 350" чистый КМп04 разлагается в —3 раза быстрее, а в присутствии 16,5% порошкообразного алюминия в —5 раз быстрее, чем при 265°. Добавка алюминия уменьшает время достижения максимальной скорости разложения 16-17.
|
Очень быстро |
Перманганаты и манганаты восстанавливаются в щелочном растворе до гипоманганатов. Так, КзМп04 получается при нагревании до 700° КгМп04 или КМпО., в смеси с 40—45% раствором КОН (при отношении К: Мп, равном 3:2). Гипоманганат калия может быть также получен выпариванием концентрированного
Раствора КОН со свежеосажденной Мп02 (отношение К:Мп равно 3,3—3,6) с последующим нагреванием в атмосфере кислорода до 750—800° и выдерживанием при этой температуре 8 ч 18. Кристаллы Na3Mn04 • ЮН20 голубого цвета выделяются при обработке щелочных растворов NaMn04 и Na2Mn04 восстановителями, например Na2S03.
Взаимодействием КМп04 с H2S04 на холоду может быть получен высший окисел марганца Мп20719. Это маслянистая жидкость со специфическим запахом, зеленая в отраженном и темно-синяя в проходящем свете, с температурой плавления +5,9° и плотностью при 20° 2,396 г/см3. При 55° начинает разлагаться на ос-Мп203 и кислород, быстро разогреваясь, и при ~90° взрывает; скорость детонации <~400 м/сек чувствительность к удару такая же, как у гремучей ртути. При взаимодействии с влагой воздуха Мп207 разлагается до Мп02 с выделением 02 и 03, но при отсутствии влаги может сохраняться в закрытом сосуде при —10° длительное время. Мп207 — сильнейший окислитель, например окисляет NaCl и Nal до NaC103 и NaI032°.
Соединения марганца, особенно Мп2+, являются ядами, вызывающими хроническое отравление. Систематическое вдыхание пыли марганцовых соединений может вызвать нервное расстройство, длящееся годами, истощение и смерть. Предельно допустимая концентрация пыли марганцовых соединений (в пересчете на Мп02) в воздухе рабочих помещений 0,0003 мг/л.
ПРИМЕНЕНИЕ
Больше 90% мировой добычи марганцовых руд потребляется металлургической промышленностью21. Они идут на изготовление ферромарганца (60—90% Мп), зеркального чугуна, силико-мар - ганца, фосфо-марганца и др. В доменном процессе марганцем обессеривают чугун. Марганец служит легирующей добавкой при получении чугуна повышенной прочности и, особенно, твердых сталей, из которых большое значение приобрели молибденово-марган - цовые. Марганец используют и в производстве сплавов на основе цветных металлов — меди (например, манганин), алюминия (дуралюмин) и др. Металлургическая промышленность использует богатые марганцем руды с минимальным содержанием Si02 и фосфора.
Использование в химической технике пиролюзита и искусственной двуокиси марганца основывается в значительной мере на хороших адсорбционных свойствах этих веществ7. Они применяются для изготовления промышленных противогазов, в качестве деполяризаторов в гальванических элементах22, в качестве низкотемпературных катализаторов для некоторых химических процессов. Таким катализатором является, например, используемый в проти - • .вогазах для поглощения окиси углерода гопкалит — смесь, содержащая 50—60% Мп02 и окиси меди, серебра или кобальта. Пер - маигаиат серебра AgMn04 является основной составной частью катализаторов, служащих для окисления СО в С02. В чистом виде он обладает низкими каталитическими свойствами, но весьма эффективен при нанесении на металлические окислы и в отличие от гопкалита не отравляется парами воды, и поэтому не требует предварительной осушки отравленного воздуха23.
Двуокись марганца хорошо поглощает пары ртути; при промывке водной суспензией Мп02 (рН = 2—5) в двухполочном пенном аппарате из газа улавливается до 99% содержащихся в нем ртутных паров. Количество поглощенной ртути достигает 20% от веса сухой Мп02 в суспензии. Ртуть может быть извлечена, а Мп02 регенерирована прокаливанием при 500° в течение 2 ч24. Восстановленную пероксидную марганцовую руду предложено использовать в качестве катализатора для селективного окисления примеси СО в азото-водородной смеси, применяемой для синтеза аммиака 25. Из окислов марганца с добавкой окислов редкоземельных элементов получают монокристаллы, обладающие пьезоэлектрическими и ферроэлектрическими свойствами.
Марганцовые руды и двуокись марганца применяются в производстве стекла, в керамической промышленности для изготовления глазури, для придания изделиям пурпурного или коричневого оттенка, а также для приготовления фиолетово-черной эмалевой краски и эмалирования железных изделий. Соединения марганца широко используются в лакокрасочной промышленности для изготовления сиккативов и в качестве красящих пигментов (углекислый марганец — марганцовый белый, окись марганца — марганцовый зеленый, метафосфат марганца — марганцовый фиолетовый и двуокись марганца — марганцовый черный). Предложено использовать марганцовые руды и получающиеся при их обогащении шламы для очистки газов от S026, от сероводорода с получением серы 27, для обессеривания сульфида натрия с получением каустической соды 28. Восстановленную пероксидную руду (МпО) используют для очистки азота от примеси кислорода — при 250—500° достигается очистка Ю-4—Ю-5 29. Искусственную двуокись марганца, изготовленную электрохимическим способом и специальной обработкой пиролюзита (ГАП — гипховский активированный пиролюзит), используют главным образом в химических источниках тока, как обладающую хорошими деполяризующими свойствами. Емкость гальванических элементов, изготовленных на ГАПе, на 15—20% выше, чем элементов, изготовленных на электролитической двуокиси марганца. Особенно ценным свойствам элементов, изготовленных на ГАПе, является их сохранность в течение длительного времени — до двух лет.
Техническими условиями установлены следующие требования к качеству продуктов.
Активированный пиролюзит для элементной промышленности (МРТУ 6—09 № 2939—66) выпускают в зернах; он должен содержать (в %):
TOC o "1-3" h z Мп02, не менее..................................................................................... . 70
Мп203, не более........................................................................................... 15
Fe203, не более............................................................................................... 1,5
Ni, не более................................................................................................. 0,03
Со, не более. . .'........................................................................................ 0,004
Си, не более............................................................................................... 0,03
Сульфатов (S04), не более............................................................................... 0,7
Влаги, не более............................................................................................. 4,0
Не растворимого в соляной кислоте остатка, не более. . 12,0
Однако более важными показателями, чем химический состав активированного пиролюзита, являются его электрохимические свойства при работе в качестве деполяризатора в элементах. В условиях стандартного испыта' я электродвижущая сила элемента 336Х должна быть в пределах 1,74—1,84 в, а емкость не #шже 1,12 а-ч [при разряде на 117 ом на элемент до 1 в (анодный режим)], при этом допускаются отклонения от указанного содержания Мп02.
Электролитическая двуокись марганца должна содержать не менее 90% Мп02 и не более: 8% Мп203, 4% гигроскопической влаги, 0,6% сульфатов (S03), 1,5% Fe203; величина рН — не менее 3,6. Через сито № 021 должно проходить 95% материала, через сито № 007 — не менее 65%.
Двуокись марганца и активированный пиролюзит упаковывают в прорезиненные или крафтцеллюлозные мешки, в стальные барабаны (лакированные внутри) или в плотные деревянные бочки, выложенные бумагой.
Перманганат калия, мировое производство которого составляет 30—40 тыс. т в год 30, применяют главным образом в качестве окислителя, в частности, для беления тканей, жиров, масел. Применение в медицине также основано на его сильных окислительных свойствах. Для этих же целей применяют и перманганат натрия, но в ограниченных количествах из-за трудности получения в чистом виде и сильной гигроскопичности. Са(Мп02)2-5Н20 применяют для обезвреживания питьевой воды. КМп04 известен как хороший дизенсектор31 и дезодоратор, используемый в уо тановках для кондиционирования воздуха32. Согласно ГОСТ 5777—71, перманганат калия 1-, 2- и 3-го сортов должен содержать, соответственно, не менее 99,0, 98,0 и 95,0% КМп04 и не более: 0,3, 0,75 и 1,0% двуокиси марганца, 0,05, 0,2 и 0,3% сульфатов в пересчете на S04 и 0,5, 0,5 и 2,0% воды. Тарой для перман - ганата калия служат стальные барабаны и банки, которые запаиваются или завальцовываются.
Хлорид марганца МпС12-4Н20 используют в текстильном производстве, для окраски кирпичей при их отжиге, добавляют в электролиты аккумуляторов; безводную соль применяют для очистки магния и его сплавов, для получения антидетонаторов, вводимых в моторное топливо.
Марганец является одним из эффективных микроэлементов, требующихся для развития растений. Его вводят в состав удобрений, например, суперфосфатов, в виде разных соединений. В Грузии в качестве микроудобрения широко используют марганцовый шлам — отход от обогащения чиатурской марганцовой руды.
Разработано33 получение марганцового микроудобрения из шлама, содержащего 77,5% Мп02, 23% МпО и 5% органических веществ. Шлам смешивают с древесными опилками и обрабатывают 98%-ной серной кислотой — получается спекшаяся рассыпчатая масса, содержащая до 60% MnS04, которую разбавляют земляной пылью или песком. При обработке водой этого продукта получаемый раствор имеет рН = 3—4. Опрыскивание листвы растений 0,25—0,12% раствором MnS04 • Н20 или опыление их порошком сульфата марганца более экономично, чем внесение марганцовых солей в почву, где они под влиянием биологических факторов окисляются и переходят в нерастворимое состояние34.
Препарат, называемый. мажефом (марганец — железо — фосфор), является смесью кристаллогидратов монофосфатов (диги - дроортофосфатов) марганца Мп(Н2Р04)2 и железа Fe(H2P04)2 и свободной фосфорной кислоты. По внешнему виду это мелкокристаллический порошок белого цвета, который, согласно ГОСТ 6193—52, должен содержать 46—52% Р205, не менее 14% Мп, 0,3—3% Fe и не более: 0,07% водорастворимых сульфатов (в пересчете на S03), 0,06% СаО, 6% не растворимых в воде веществ и 19% влаги. Мажеф применяют для фосфатирования стали — нанесения защитного покрытия, предохраняющего сталь от коррозии. Общая кислотность мажефа, выраженная в количестве миллилитров 0,1 н. раствора NaOH, требующихся для титрования на 0,3 г препарата, должна быть не меньше 25. При погружении стального изделия в нагретый до 98° раствор мажефа происходит растворение железа с выделением водорода, а на поверхности металла осаждается плотный, прочный и не растворимый в воде кристаллический защитный слой фосфорнокислых солей серо-черного цвета. Когда этот слой достигает определенной толщины, дальнейшее растворение железа прекращается (стр. 785).
СЫРЬЕ
В земной коре содержится 0,09% Мп — в 50 раз. меньше, чем Fe, но больше, чем любого другого тяжелого металла36. Марганец встречается только в связанном виде, главным образом в марганцовых и железных рудах осадочного происхождения и в малых
Концентрациях в минеральных и морских водах, и во всех растительных и животных тканях. Марганцовые руды подразделяют нa^ три класса: марганцовые — при содержании Мп > 40%, Fe < 10%; железомарганцовые — 5—40% Мп, 10—35% Fe; марганцовистые железные руды при содержании Мп<5%. Запасы марганцовых руд СССР значительно превосходят запасы во всех других странах мира 36. Важнейшими месторождениями высококачественных марганцовых руд являются Чиатурское в Грузии и Никопольское в Украине 37>38. Чиатурская пероксидная руда представлена пиролюзитом, псиломеланом, манганитом, браунитом и содержит 60—70% Мп02. Основная примесь — кремнезем. Концентрат, получаемый после мокрого обогащения руды, содержит до 96% Мп02. Для нужд химической промышленности потребляется сырье, содержащее не меньше 70% Мп02. Чиатурские карбонатные. марганцовые руды представлены манганокальцигами и кальциевыми родохрозитами. Обогащенная руда содержит более 22 % Мп. При нагревании руды сначала диссоциирует МпСОз, затем СаС03. Это может быть использовано в некоторых методах обогащения карбонатных РУД39.
Разрабатываются методы химического обогащения инфильтра - ционных руд Чиатурского месторождения (кремнистых пород, пропитанных гидроокисью марганца) — восстановительным обжигом с последующей обработкой серной кислотой, а также хлорированием 40.
Никопольская руда несколько менее высокого качества, чем Чиатурская, — содержание Мп02 в ней на 15—20% ниже, а содержание Si02 доходит до 15%. Она представлена пиролюзитом и псиломеланом.
Крупные месторождения марганцовых руд осадочного характера, кроме СССР, находятся в Индии, Бразилии и Гане; в других странах месторождения значительно меньшей мощности с рудами невысокого качества.
Для промышленности Урала и Сибири представляет интерес использование местных бедных марганцовых руд21, содержащих 26—28% Мп, 2—6% Fe, 30—40% Si02, 0,05—0,1% S. Марганцовые руды Полуночного и некоторых других месторождений Урала состоят из разных типов оксидных руд — пиролюзитовых, псиломе - лановых и др. В некоторых образцах полуночной руды содержится до 0,02% молибдена41. Концентрат, полученный обогащением пиролюзитовых руд Полуночного месторождения, как и чиатурская пиролюзитовая руда, может быть использован для непосредственного изготовления элементов или активированной двуокиси марганца.
При мокром обогащении марганцовых руд из-за размыва мягких минералов образуются шламы, представляющие собой тонкие фракции руд. Эти шламы трудно осаждаются и поэтому в значительной мере теряются со сбросными водами. Шламы содержат 18—30% Мп, и поэтому их использование имеет существенное экономическое и санитарное значение42. Установлена возможность ускорения осаждения шламов с помощью сенсибилизаторов 43. Переработка шламов, как и бедных марганцовых руд, возможна только химическим путем, так как эффективный метод флотации окисных марганцовых минералов пока не найден44. Шламы и бедные марганцовые руды применяют в качестве удобрений.