Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ПОЛУЧЕНИЕ ХЛОРИСТОГО ВОДОРОДА
Сырье
Сырьем для получения хлористого водорода и сульфата натрия служат поваренная соль (обычно измельченная каменная соль — бузун) и купоросное масло — 92—93%-ная серная кислота. Менее концентрированную серную кислоту не применяют, так как в этом случае хлористый водород был бы чрезмерно разбавлен парами воды, что затруднило бы получение концентрированной соляной кислоты. Применение крупнозернистой выварочной соли предпочтительнее вследствие ее пористости — она легко пропитывается кислотой с образованием однородной массы. Однако выварочная соль содержит переменное количество влаги, что затрудняет дозировку сырья и регулирование температурного режима печей. Каменная соль характеризуется постоянной влажностью, но она более загрязнена примесями CaS04, Fe203 и другими (см. гл. III), переходящими в сульфат натрия. Помимо этого, применение каменной соли связано с необходимостью ее измельчения и более интенсивного перемешивания с серной кислотой34.
Физико-химические основы взаимодействия хлористого натрия с серной кислотой
Реакция между хлористым натрием и серной кислотой 2NaCl + H2S04 = Na2SO., + 2НС1
— эндотермическая. При применении серной кислоты концентрацией меньше 100% расход тепла на реакцию увеличивается за счет дегидратации серной кислоты. В табл. 31 приведены значения теплового эффекта АН и изменения изоба^ ого потенциала AZ для Некоторых реакций взаимодействия NaCl С серной кислотой и кислыми сульфатами натрия при различных температурах85.
|
ТАБЛИЦА 3J Значения ДИ и SZ Реакций взаимодействия хлористого натрия с серной кислотой и кислыми сульфатами натрия
|
Взаимодействие хлористого натрия с серной кислотой начинается даже при 0° с выделением в газовую фазу почти безводного НС1, но быстро прекращается; жидкая фаза представляет собой раствор образовавшегося сульфата натрия в серной кислоте. При нагревании реакция возобновляется — одновременно с хлористым водородом удаляется водяной пар вследствие дегидратации серной кислоты. Обезвоживание жидкой фазы облегчается тем, что растворение образующегося сульфата натрия в серной кислоте повышает равновесное давление водяного пара.
В системе Na2S04—H2S04—Н20 при 25° существуют следующие твердые фазы: Na2S04 • 10Н20, Na2S04 • 4,5Н20, Na2S04, NasH(S04)2, NaHS04-H20, NaHS04 и NaH3(S04)2 • H20. При 0й существуют эти же фазы и H2S04-H20; NaH3(S04)2 • Н20 находится в метастабильном состоянии, имеется метастабильная фаза Na2S04 • 5,5Н20 36. Однако поскольку реакцию с хлористым натрием ведут при высокой температуре и используют концентрированную серную кислоту, содержащую очень мало воды, вскоре удаляющейся в газовую фазу, практически процессы идут в без
водной системе. В зависимости от температуры реакционной массы образующийся сульфат натрия может полностью оставаться в жидкой фазе или частично кристаллизоваться из нее в виде кислых солей: 2Na2S04-9H2S04, Na2S04 • 2H2S04, Na2S04-H2S04 (бисульфат или гидросульфат натрия NaHS04) и 3Na2S04 • H2S04 [тринатрийгидросульфат Na3H(S04)2]. Нейтральный сульфат кристаллизуется только в заключительной стадии процесса37.
На рис. 114 дана диаграмма растворимости в двойной системе H2S04—Na2S0437. Молярные проценты Na2S04 (верхняя шкала) численно равны степени превращения NaCl в Na2S04. Растворимость сульфата натрия в серной кислоте сильно возрастает, начиная от 4% (вес.) при 0° до 59% при 186°. При повышении температуры до 270° растворимость увеличивается до 67%.
Во избежание преждевременного затвердевания реакционной массы необходимо, чтобы температура на каждой стадии процесса была не ниже той, при которой исчезает жидкая фаза. Реакция в сульфатных печах протекает с высокой интенсивностью, если температурные условия не допускают значительной кристаллизации промежуточных кислых сульфатов натрия. Так, если успела прореагировать третья часть хлористого натрия, а температура при этом еще не достигла 109°, вся масса затвердевает в смесь кристаллов NaCl и Na2S04-2H2S04. Когда в некоторой зоне печи, где температура ниже 186°, NaCl прореагировал на 50%, там будут находиться в твердом состоянии хлористый натрий и бисульфат натрия— жидкая фаза будет отсутствовать. Если NaCl прореагировал на 75% и температура будет ниже 270°, реакционная масса полностью затвердевает, образуя конгломерат, состоящий из остатка NaCl и Na3H(S04)2. Последний особенно часто образуется в сульфатных печах. Выше 270° тринатрийгидросульфат инконгруэнтно плавится, и освобождающаяся серная кислота реагирует с оставшимся хлористым натрием — появляется кристаллический нейтральный сульфат натрия.
ТАБЛИЦА 32
Примерное содержание NaCl И Na2S04 В реакционной массе при различной степени разложения NaCl
Степень
NaCl, вес. К Na2S04, вас. К разложения NaCl,
%
|
25,2 22,0 9,3 5,7 |
|
38,3 61,0 81,7 86,7 90,7 |
|
55,6 69,6 88,0 92,6 96,4 |
|
2,8 |
Изменение содержания NaCl и Na2S04 в реакционной массе и степень разложения хлористого натрия по мере взаимодействия его с серной кислотой показаны в табл. 32 37.
Реакции, рассмотренные в табл. 31, являются обратимыми, т. е газообразный хлористый водород может вытеснять серную кислот из нейтрального и кислых сульфатов. Равновесное давление НС1
|
10 |
|
Мол. "Л 20 30 40 00 60 70 80 90!00 |
|
0 10 20 30 40 50 60 70 80 90 108 Вес. % Na2SQ4 |
|
$50 500 M 400 ' V, 350 !300 | 250 I 200 И ISO 100 Во о |
|
Мол. У» 50 75 |
|
^ ВО |
|
H2S04 У, 40 ВО ВО K2SO* Вес. % |
|
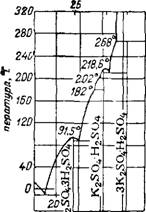
Рис. 115. Политерма растворимости в системе H2S04--K2S04. |
|
H2So4 |
|
Рис. 114. Политерма растворимости в системе H2S04—Na2S04. |
Системе NaCl + 2NaHS04 (реакция б) вычисляется по формуле IgP = —2241,27-1 + 5,37; оно равно при 25° 0,007 ат, при 138° 0,83 ат, При 144° 1 ат, при 186° 3,09 ат. Равновесное давление НС1 в системе NaCl--Na3H(S04)2 (реакция 6):
|
T, "С |
|
25 |
|
Р, ат............................ 27-10"" |
127 160 227 270 0,202 0,87 9,4 32,6
Получение НС1 взаимодействием H2SC>4 с КС1, в отличие от NaCl, требует несколько более высоких температур (на 100—150°) для своего завершения. На рис. 115 приведена политерма системы H2S04 — K2S0438'39. Для полного разложения остатков жидкой фазы в этой системе требуется нагреть ее до 700—750°.