Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение сульфида натрия восстановлением сульфата натрия газами
Восстановление сульфата натрия не твердым углем, а газообразными восстановителями (природным, генераторным и другими газами) по суммарным реакциям
Na2S04 + CH4 = Na2S + C02 + 2H20 Na2S04 + 4СО = Na2S + 4С02 Na2S04 + 4Н2 = Na2S + 4НаО
Дает возможность сразу получать продукт, не загрязненный углем, и устраняет необходимость громоздких операций по переработке плава — выщелачивания, отделения шлама, выпаривания щелоков. Помимо этого, газ является более дешевым восстановителем, чем твердое топливо.
Выход Na2S При восстановлении сульфата натрия водородом и водяным газом при 800° в течение 1 ч составляет ~85% от теоретического. Восстановление окисью углерода идет медленнее, чем водородом, а метаном еще медленнее85. Отсутствие конструкций печей, в которых можно было бы осуществлять достаточно полное восстановление газом жидкой реакционной массы — расплавленного сульфата, затрудняло организацию этого процесса в заводских масштабах. Восстановление сульфата натрия газами при низкой температуре, исключающей возникновение жидкой фазы, протекает сравнительно медленно86.
Из многих газовых восстановителей — окиси углерода, водорода, метана, генераторного и природного газа — в настоящее время для получения Na2S В промышленном масштабе используется лишь водород. Это объясняется тем, что в присутствии примеси небольших количеств катализаторов (меньше 0,2% соединений железа, никеля, меди и др.) сульфат натрия восстанавливается водородом в сернистый натрий при температурах более низких, чем температуры плавления сульфата и его эвтектических смесей. Восстановление начинается при 500° и протекает с достаточной скоростью при 600°, что позволяет избежать оплавление материала. Получается безводный продукт, содержащий больше 95% Na2S, Называемый сульфиграном (сульфид гранулированный) 27'87. С повышением содержания водяного пара в газе равновесие основной реакции
Na2SO, + 4Н2 Na2S + Н20
Сдвигается влево и ее скорость резко уменьшается. При 20% Н20 в газе и 630° довести реакцию до конца невозможно. Кроме того, повышенное содержание водяного пара ускоряет побочную реакцию, приводящую к потере серы в виде H2S:
Na2S + 2НгО 2NaOH + H2S,
Поэтому если осуществляется рециркуляция водорода, подаваемого в восстановительную печь в большом избытке, то по выходе газа из печи водяной пар должен быть сконденсирован в процессе рекуперации тепла (см. рис. 149).
Восстановление сульфата натрия природным газом или метаном, вероятно, связано с диссоциацией последнего, происходящей при высоких температурах (800—1000°). Разложение метана ускоряется в присутствии древесного угля, кокса, железа, никеля и др. Выход Na2S При 600° незначительный, сильно возрастает выше 750°, при 800° за 3 ч достигает -88%, а при 850° —95%. Более высокая температура приводит к загрязнению продукта углеродом, выделяющимся при разложении метана, а более длительное нагревание —к образованию побочных продуктов. При восстановлении не выше 850° содержание углерода в продукте меньше 1 % 88<89.
Восстановление сульфата натрия окисью углерода начинается около 700°, уже при 730° протекает со значительной скоростью, а при 850° практически заканчивается в течение 25 мин. Процесс сопровождается побочными реакциями, приводящими к образованию соды и серы®0:
3Na2S04 + Na2S + 8СО = 4Na2C03 + 4С02 + 4S
В присутствии водяного пара образование соды из побочного процесса превращается в основной; восстановление окисью углерода идет по реакции
Na2S04 + 4СО + Н20 = Na2C03 + ЗС02 + H2S
А восстановление полуводяным газом по реакциям Na2S04 + Н2 + ЗСО = Na2C03 + H2S + 2С02 Na2S04 + 2Н2 + 2СО = Na2C03 + H2S + С02 + Н20
Причем с увеличением парциального давления водяного пара предотвращается плавление материала и ускоряется образование соды.
Полуводяной газ при 630° и /?HjO = 0,35 Ат за 4 ч восстанавливает сульфат на 97,2% с выходом Ыа2СОз 92,7%- Это послужило
![]()
|
Газ |
|
Л. |
|
|
|
Коксовый |
|
Ь |
357ор-р NaOH м-г-^ 1 50%р-рNaOHЕЕЗЗ|
JL
С
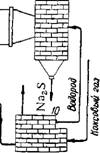
Рис. 149. Схема производства сернистого натрия восстановлением сульфата натрия водородом во вращающейся печи:
/ — бункер для сульфата; 2 —печь с вращающимся подом для предварительной прокалки сульфата; S-пгчь для восстановления сульфата; 4 — циклон; 5 — теплообменник; 6 — скруббер с керамичз^кои насадкой для охлаждения газа и конденсации водяного пара; 7 и 8 — скрубберы со стальной насадкой для поглощения H2S и осушки газа;
9 — газодувка; 10 — подогреватель водорода.
Основанием для разработки метода получения соды восстановлением сульфата натрия газами91-94.
Скорость восстановления сульфата натрия в сульфид газами растет с увеличением расхода газа и дисперсности частиц Na2SO,T, А при относительно низких температурах также в присутствии катализаторов— при высоких температурах скорость реакции становится настолько большой, что роль катализаторов оказывается несущественной. Однако, если относить скорость реакции не к единице поверхности раздела фаз, а ко всей массе сульфата, то ускорение реакции с повышением температуры идет лишь до некоторого пределаи По мере оплавления частиц реакционная поверхность Уменьшается и процесс замедляется. Так, восстановление водородом' пРи температурах выше 650° дает меньшие выходы - Na2S, Чем
при более низкой температуре (полное восстановление при 650° достигается лишь за 15 ч). Выше 800" наблюдается полное сплавление реакционной массы. Предотвратить отрицательное влияние плавления материала на ускорение процесса с повышением температуры можно, если в начале процесса поддерживать 600—610° и повышать температуру до 700—710° только после того, как степень восстановления превысит ~50%, когда содержание Na2S В реакционной смеси будет больше, чем в эвтектике (стр. 472), и температура плавления начнет возрастать. Таким способом за 8 ч Можно получить продукт, содержащий 96% Na2S 85. Уменьшение оплавления материала достигается также при предварительном гранулировании или брикетировании сульфата. Предложено добавлять к сульфату натриевую соль алифатической кислоты с целью осуществления процесса во вращающейся печи без спекания с получением зерненого продукта95.
Изучено восстановление брикетов сульфата натрия газами пиролиза нефти в стационарном и в псевдоожиженном слое". В условиях восстановления сульфатных брикетов при 700—725° в шахтной печи основными восстановителями в этих газах являются водород и олефины. Парафиновые углеводороды участвуют в восстановлении в меньшей степени. В присутствии соединений железа скорость восстановления увеличивается 96.
При промышленном восстановлении сульфата натрия водородом в качестве катализатора используют обычно железо. При содержании в сульфате всего лишь 0,07—0,08% Fe Скорость процесса' уже достаточно велика при 600—650°87. Для равномерного распределения катализатора его следует вводить в сульфат в виде водного раствора какой-либо соли, например, FeS04.
Предложено также получать сульфат, легко восстанавливаемый водородом при 700° во вращающейся печи, смачиванием смеси сульфата с колчеданным огарком 35%-ной серной кислотой (1,5 кг Огарка и 20 - кг кислоты на 100 т сульфата) и последующим брикетированием 9Г.
На рис. 149 показана принципиальная схема производства сернистого натрия восстановлением сульфата натрия водородом на заводе в Леверкузене 98. Восстановление осуществляется в горизонтальной вращающейся (I об/мин) печи длиной 20 ж с наружным диаметром барабана 3,1 м. Концы барабана имеют форму усеченных конусов с диаметром малых оснований 1,6 м, что обеспечивае толщину слоя перемещающегося в печи материала 0,75 м. Печ футерована шамотным кирпичом по слою теплоизоляции из стеклянной ваты. Герметичное уплотнение между барабаном и непод рижными головками печи достигается с помощью лабиринтов, за й-олненных под давлением вязкой (хлорнафталиновой) смазкой Загрузка и выгрузка материала из печи производится с помощь - торцовых шнеков. Сульфат натрия из сульфатных печей, размолоТый до тонкости 1—2 мм, для освобождения от серной кислоты обрабатывается небольшим количеством сульфита натрия и для окончательного удаления H2SO4 Прокаливается при 600° в обогреВаемых коксовым газом печах с вращающимся подом. Затем он с температурой 400—450° поступает в восстановительную печь. Катализатор— пыль из электрофильтров колчеданных печей — добавляется в сульфат перед прокалкой. Водород, поступающий из производства хлора, подается в восстановительную печь нагретым до. 820° в трубчатом подогревателе из жароупорной стали, где сжигается коксовый газ. Количество водорода (720 мъ/ч) в 6—8 раз превышает теоретическое. Газ, выходящий из печи, очищают в циклоне от сульфатной пыли, возвращаемой в прокалочную печь, и охлаждают в теплообменниках с 530 до 150—170°, затем для дальнейшего охлаждения и конденсации водяного пара промывают холодной водой, а для поглощения H2S И осушки 35 и 50% растворами NaOH. После этого вместе со свежим водородом циркулирующий водород через теплообменники (в которых подогревается до 400°) и через нагреватель возвращается в печь. В системе поддерживается избыточное давление в несколько сотых долей ат. Сернистый натрий выходит из печи в виде кусков 10—15 см с температурой 750° и охлаждается в стальном барабане, а затем в шнеке с водяной рубашкой. В этих аппаратах и в элеваторе между ними продукт находится в атмосфере азота. Затем перед тарированием его измельчают в молотковой дробилке до размера кусков 5 мм. Готовый сульфигран содержит 95% Na2S, 2% Fe203, 0,5—1% Na2C03, 1% NaCl И 1—1,5% Na2S203 И Na2S03. На 1 т сульфи - грана (в пересчете на 98% Na2S) Расходуют 1,85 т сульфата натрия, 1350 м3 водорода, 820 кет • ч электроэнергии и ~ 1300 мъ коксового (или генераторного) газа.
На другом заводе (в Вольфене) восстановление сульфата натрия водородом производят в шахтных печах 45-89'97. Горячий сульфат из механических сульфатных печей охлаждается в холодильнике до 40—50°, а затем в наклонном шнеке, где он смачивается водой (3—4%); после этого его брикетируют. Сульфат должен содержать 0,2—0,3% Fe. Брикеты овальной формы размером 40— 50 мм с плотностью 1,8—2 г/см3 для усиления прочности вылеживаются на складе 24 ч. Затем через сито для отсева мелочи и пыли брикеты поступают в отапливаемую генераторным газом наклонную вращающуюся печь, где нагреваются до 550—600°, причем из них удаляется влага, а содержание NaCl За счет реакции с H2SO4 (бисульфатом) снижается до 0,1% (большее содержание NaCl Нежелательно). Нагретые брикеты поступают через питатель в шахт - нУю восстановительную печь производительностью 7—8 т сульфи - гРана в сутки. Шахта печи цилиндрической формы футерована Шамотом. Между футеровкой и стальным кожухом кизельгуровач изоляция. Шахта разделена вертикальной шамотной стойкой на три вертикальные секции, к каждой из которых подводится водород. Водород поступает с хлорного завода; он подогревается до 400° в теплообменниках за счет тепла уходящего из печи газа, а затем до 700—710° в электрическом подогревателе, в котором сопротивлением служат графитовые шары диаметром 40 мм. Подогреватель представляет собой футерованную камеру с электродами, присоединенными к однофазному трансформатору (6000 а, 60 в). Водород, выходящий из печи с температурой 560°, очищается от сульфатной пыли в циклоне, охлаждается в теплообменниках до ~150°, затем в водяном скруббере до 25—30°, где освобождается от основной массы водяного пара. После этого, вместе со свежей долей водорода, с помощью компрессора газ возвращается в цикл. Он должен содержать не меньше 97% Н2 и не больше 30 г водяного пара в 1 ж3; количество проходящего через печь водорода в 5 раз больше теоретического. Выгрузка сернистого натрия из печи производится с помощью вращающегося стола (1 об/ч). Продук" представляет собой гранулы серо-коричневого цвета и содержит 96—97% Na2S, 0,4% Na2S203, 0,7% Na2S03, 0,36% NaHS, 0,4% Na2C03, 0,4—0,6% Fe203, 1,4% нерастворимых веществ. На 1 т продукта расходуется 1,9 т сульфата натрия, 1320 ж3 водорода, 720 м3 Генераторного газа, ~1000 квт-ч электроэнергии, 60 м3 воды (п другим данным, 15 ж3) и 15 чел.-часов рабсилы.
Недостатком этой схемы является необходимость гранулирования сульфата натрия, что, помимо затрат на этот процесс, приводит к уменьшению реакционной поверхности материала, к замедлению восстановления (продолжительность пребывания материал" в печи достигает 20 ч) и увеличению необходимых размеров печи.
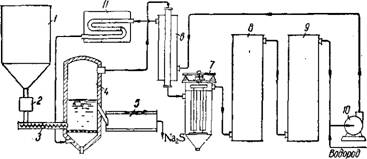
Восстановление сульфата газами может быть значительн интенсифицировано и усовершенствовано при осуществлении ег в циклонных печах", а также в печах со взвешенным слое (рис. 150). Здесь можно подвергать восстановлению сульфат. размерами зерен меньше 2 мм. Имеется много предложений п осуществлению восстановления сульфата натрия во взвешенно слое, направленных главным образом к предотвращению агломе рации частиц45'100~105. Так, например, для этого предложено реакционное пространство, заполненное в основном сульфидо натрия, вводить сульфат в таком количестве, чтобы его содержа ние в массе составляло 5—10%. Это позволяет вести процесс бе спекания частиц при постоянной и оптимальной температуре, пре вышающей эвтектическую, находящейся в пределах 675—750 (в зависимости от вида катализатора). При размере зерен суль фата 0,2—0,3 мм в присутствии 1% железного катализатора, дли тельность восстановления водородом составляет 8 мин. Рекомен дуют поддерживать температуру стенок печи ниже или равно температуре реакционной смеси, чтобы исключить частичное шлако вание, особенно на стенках. Это достигается подачей в печь суль фата и газа, предварительно нагретых до температуры, превышающей реакционную.
Одним из существенных преимуществ восстановления сульфата натрия водородом является прямое получение продукта с содержанием 96—98% Na2S Без необходимости производить переработку плава, дающую к тому же продукт, содержащий только 65% Na2S, Перевозка которого требует повышенных транспортных расходов. Однако этот способ имеет и недостатки: большой расход водорода; необходимость организации установки для получения
|
Рис. 150. Принципиальная схема производства сернистого натрия восстановлением сульфата натрия во взвешенном слое: J — бункер для сульфата; 2—автоматический питатель сульфата; 3 — шнек; 4 — реактор-восстановительная печь со взвешенным слоем сульфата; 5 — холодильный барабан для охлаждения сернистого натрия; 6 — газовый теплообменник; 7 — электрофильтр для улавливания пыли, уносимой водородом из реактора; 8 — водяной скруббер для охлаждения водорода и конденсации водяного пара; 9 — скруббер для отмывки водорода от H2S; 10 — газодувка; // — нагреватель Водорода. |
Азота, требующегося для промывки аппаратуры перед пуском и Остановкой, во избежание образования гремучей смеси; необходимость применения сульфата, не содержащего хлористого натрия (понижающего температуру появления жидкой фазы в системе Na2S04—Na2S). В связи с большой стоимостью водорода использование этого способа рационально пока лишь в районах с избыточным балансом водорода, особенно при наличии там природного сульфата.
Более перспективным, и потому заслуживающим дальнейшей разработки и производственного освоения, является восстановление сульфата натрия природным газом и газами, содержащими СО — отходящими из производств фосфора, карбида кальция и др., — а также коксовым газом. Помимо того, что эти газы дешевле водорода, а вернее, именно поэтому, можно не возвращать в цикл непрореагировав-шую часть газа, а использовать ее в качестве топлива; это значительно упростит технологическую схему и Снизит капитальные и эксплуатационные затраты.
Другие способы получения сульфида натрия
Сравнительно малые количества сернистого натрия получаются не восстановлением сульфата натрия, а другими способами. При улавливании раствором едкого натра отбросного сероводорода 106'107, получающегося, например, при производстве хлористого бария, сероуглерода, при очистке нефти, или сероводорода,, извлеченного из коксового и других промышленных газов, образуется гидросульфид натрия (см. ниже) или сернистый натрий по реакции:
2NaOH + H2S = Na2S + 2Н40
Вместо едкого натра для поглощения сероводорода можно пользоваться известковым молоком с примесью соды: Na2C03 + Са(ОН)2 + H2S = Na2S + СаСО, + 2НгО
Сернистый натрий получается при сливании растворов гидросульфида и едкого натра:
NaHS + NaOH = Na2S + Н20
Na2S Получается также путем переработки содержащих Са$ отвалов, образующихся в производстве соды из сульфата натрия, известняка и угля или в производстве хлористого бария хлоркаль - циевым методом. При разваривании этих отвалов в растворе, содержащем соду и сульфат натрия, происходит гидролиз CaS По уравнению:
2CaS + 2HsO = Ca(HS)2 + Са(ОН)2
Са(ОН)2 каустифицирует соду по реакции:
Са(ОН)2 + Na2CO, = 2NaOH + СаСО,
А в результате реакции
Ca(HS)2 + Na2S04 = CaS04 + 2NaHS
Получается гидросульфид натрия, образующий с едким натром Na2S. Общее уравнение процесса имеет вид:
2CaS + Na2C03 + Na2S04 = CaS04 + СаСО, + 2Na2S
Полученный раствор сернистого натрия отделяют от осадков и выпаривают.
Предложенб производить Na2S Одновременно с сульфитом натрия взаимодействием серы с кипящим 50% раствором едкого натра. Нагревание продолжают пока температура кипения раствора не достигнет НО—150°. При этом Na2S Остается в растворе, а сульфит натрия выделяется в твердом виде и после охлаждения смеси до 120—110° ЫагЗОз отделяют центрифугированием. Затем раствор охлаждают до 20—25°, отделяют выделившийся кристаллический сернистый натрий, а маточный раствор возвращают в процесс103.
Так как восстановление сернокислого бария в промышленных условиях осуществляется с меньшими трудностями, чем восстановление сернокислого натрия, то сернистый натрий можно получать обработкой плава сернистого бария раствором сернокислого натрия по реакции:
BaS + Na2S04 = BaS04 + Na2S
Осадок сернокислого бария, отделенный от раствора ЫагЭ, может быть вновь возвращен на восстановление109. Сернистый натрий получают также в качестве побочного продукта при производстве углекислого бария по реакции:
BaS + Na2C03 =■= Na2S + ВаСОэ
Раствор Na2S, остающийся после отделения осадка ВаСОз, выпаривают.
При обработке смеси поваренной соли с углем концентрированной серной кислотой в механических муфельных сульфатных печах или в пламенных печах при 650° получается плав, содержащий больше 60—62% Na2S uo. Процесс идет по схеме:
2NaCl + 2С + H2S04 = 2НС! + Na2S + 2С02
Здесь совмещаются две реакции: образование сульфата натрия и хлористого водорода и восстановление сульфата углем. Таким образом, можно получать сернистый натрий непосредственно из поваренной соли, минуя стадию предварительного производства сульфата. Выделившийся при этом хлористый водород, как и при получении сульфата, поглощается водой с образованием соляной кислоты.
Описано получение Na2S, основанное на разложении амальгамы натрия, образующейся при электролизе поваренной соли с ртутным катодом, раствором полисульфида натрия или серой по реакциям:
6Na + Na2S4 = 4Na2S; 2Na + S = Na2S
При обработке амальгамы, содержащей 0,2% Na, раствором состава: 10—11% NajS и 11 —12% полисульфидной серы, получается раствор, содержащий 29—30% Na2S и 0,2—0,3% Na2S208, который без дальнейшей переработки используют в производстве красителей93.