Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ПЕРХЛОРАТЫ НАТРИЯ, КАЛИЯ И АММОНИЯ И ХЛОРНАЯ КИСЛОТА50′ 5Э — 211
Производство перхлоратов осуществляют почти исключительно электрохимическим путем. Электролизу подвергают водный раствор хлората натрия. Однако получающийся перхлорат натрия не находит широкого применения вследствие его сильной гигроскопичности и расплывания на воздухе. Обменным разложением его с хлоридами или сульфатами калия или аммония получают перхлорат калия или аммония.
Перхлорат калия может быть получен также при нагревании Хлората калия при 350—450°:
4КС103 = ЗКСЮ4 + КС1
В результате выщелачивания застывшего плава водой (или оборотными растворами) КС] переходит в раствор, а труднорастворимый КС104 остается в осадке. Однако этот метод в промышлент ности не применяется.
Аналогичным образом — термическим разложением ЫаСЮз при 400—600° можно получить и перхлорат натрия212. Предложено 213 осуществлять окисление хлората калия до перхлората двуокисью свинца в сернокислой среде.
Перхлорат натрия
Электрохимическое окисление хлорат-иона на аноде протекает с образованием хлорной и хлорноватой кислот:
2C10J + Н20 = НС104 + НСЮ3 + 2е
Одновременно на катоде происходит разряд ионов водорода и образование щелочи, взаимодействующей с НС103 и НС104:
2Н20 + 2е = Н2 + 20 Н - НСЮ4 + НСЮ3 + 20Н" = C10J + СЮ; + 2НГО
Таким образом, суммарный процесс может быть представлен уравнением:
Сю; + Н20 - СЮ4 + Н2
Электролиз осуществляют с применением в качестве анодов платиновых сеток, а в качестве катодов — перфорированных никелевых пластинок 214.
В качестве катодных материалов могут быть также использованы нержавеющая сталь и графит. Во избежание потерь тока вследствие частичного разряда ионов ОН", особенно увеличивающихся в конце процесса (при малой концентрации ионов С10^~), поддерживают небольшую кислотность электролита в пределах 0,1—0,15 г/л НС1195. При избытке кислоты может произойти химическое разложение хлората, а также разряд ионов хлора на аноде.
При концентрации электролита 500—700 г/л ЫаСЮз, температуре 40—60°, анодной плотности тока 3000—7000 а/м2 и катодной — 1000—2000 а/м2, напряжении 6—10 в, начальный выход по току составляет 95—98%. К концу процесса при концентрации NaC104, равной 900—1000 г/л, и ЫаСЮз ниже 50 г/л выход по току уменьшается до 40—50%. В среднем он составляет около 85%, и расход энергии на 1 г ЫаСЮз колеблется в пределах 3000—3500 квт-ч.
Некоторое снижение температуры или повышение ее до 60—70° не влияет заметно на выход по току. Повышение температуры приводит к увеличению износа платинового анода, но к уменьшению напряжения на электролизере215. Поэтому обычно работают при 40—60°. Считают 215, что оптимальной плотностью тока на аноде, при которой достигается минимальная стоимость продукта, должна быть 0,4—0,5 а/см2.
Когда электролиз осуществляют с применением платиновых анодов и стальных катодов, в электролит добавляют 3—4 г/л ЫагСггО? для предотвращения восстановления катодов. В этом случае наилучшие выходы по току достигаются при 30—40°. Тепло реакции отводят искусственным охлаждением. После нейтрализации конечного раствора, содержащего 900—1000 г/л NaC104 и 50 г/л ЫаСЮз, и выпаривания его до концентрации 1300—1350 г/л NaC104 из него кристаллизуют твердый перхлорат натрия.
Представляет интерес осуществление процесса с получением раствора, содержащего минимальное количество хлората, который непосредственно может быть использован для получения перхлората аммония211. Указывают215, что при электролизе начального раствора, содержащего 600—700 г/л NaC103, в серии ванн с циркуляцией электролита концентрация в конечном растворе перхлората достигает 1000 г/л, а хлората составляет 3—5 г]л.
В последнее время большое внимание уделяется сокращению количества платины в производстве перхлората, или замене ее другими материалами для изготовления анодов211. Возможно использование тантала или титана в качестве токоподводящих металлов, на которые наносится слой платины 50> 215-217 Описано 216 использование в производстве перхлората натрия анодов из двуокиси свинца, нанесенной электроосаждением на токоподводящую основу из графита. Устранение механических повреждений покрытия и придание ему однородности достигается обработкой эпоксидной смолой, силиконовым каучуком или другими аналогичными материалами. В качестве токоподводящей основы для анодов из двуокиси свинца вместо графита можно также применять тантал 50>215.
При использовании анодов из двуокиси свинца, выход перхлората натрия по току несколько ниже (на <~5%), чем при работе с платиновыми анодами. Это наблюдается в особенности на последних стадиях электролиза — при малых концентрациях хлората в конечном растворе.
Получение перхлората с применением РЮ2 в качестве анода ведут при анодной плотности тока 0,15 а/см2 и катодной — 0,07 а/см2 при напряжении 4,7—5,7 в. К раствору добавляют 0,5 г/л NaF и не вводят Na2Cr207. Добавка фторида позволяет завершить процесс при конечной концентрации №С10з в растворе такой же, какая достигается на платиновых анодах без резкого уменьшения выхода по току, который составляет в среднем 90%.
Перхлорат калия
Перхлорат калия получают обменным разложением NaC104 и КС1. Раствор, содержащий 600 г/л NaC104, после фильтрации от механических примесей направляют в кристаллизатор, куда одновременно подают раствор хлорида калия. Массу охлаждают не ниже 20—25° во избежание образования твердых растворов 21Э. Выход перхлората калия составляет 95%. Кристаллы отделяют на центрифуге, высушивают до содержания 0,01—0,04% влаги и измельчают в дезинтеграторе. В готовом продукте содержится до 99,5% КС104.
Перхлорат аммония
Перхлорат аммония производят обменным разложением перхлората натрия и хлорида аммония. Исходными материалами служат перхлорат натрия, аммиак и соляная кислота 220'221.
|
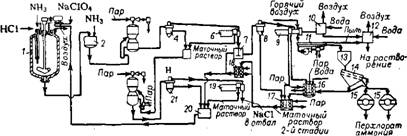
Рис. 443. Схема производства перхлората аммония: / — реактор; 2 — бак; 3, 22 — кристаллизаторы; 4, 8, 21 — питатели центрифуг; 5, 17, 20 — резервуары для маточных растворов; 6, 9, 19 — центрифуги; 7— мешалка для пульпы; 10, 12 — скрубберы; II — вибрационная сушилка; 13 — бункер; 14 — вибрационное сито;/5 —смеситель; IS — растворитель пыли; 18 — запасной сборник для маточного Раствора. |
На рис. 443 представлена схема производства перхлората аммония. В реактор загружают 56% раствор перхлората натрия, рециркулирующие растворы и промывные воды. Затем при медленном перемешивании подают в раствор 35%-ную соляную кислоту и аммиак в количестве, меньшем, чем стехиометрическое (рН = 5,5 при 70—80°). Из реактора раствор поступает в бак 2, Куда подают дополнительное количество аммиака, необходимое для завершения реакции обменного разложения. Из полученного раствора выкристаллизовывают NH4CIO4, который характеризуется наименьшей растворимостью в образующейся системе. Его отделяют центрифугированием, предварительно подсушивают до влажности 0,5% в центрифуге-сушилке и окончательно до влажности 0,02% в трехступенчатом вибрационном агрегате222. Из маточного раствора выделяют кристаллизацией NaCl, который также отделяют на центрифуге. Оставшийся маточный раствор используют для приготовления исходной смеси. Для использования отхода — кристаллического NaCl (например, для производства хлората натрия) предложено 223 очищать его от примесей NH4CIO4 топочными газами, нагретыми до 500—800°.
Неслеживающийся перхлорат аммония можно получить путем обрызгивания кристаллов NH4CIO4 водным раствором солей три- сульфокислот аминоарилметилкарбинола 224.
Наиболее распространенным способом производства хлорной кислоты является солянокислотный, заключающийся в вытеснении хлорной кислоты из перхлората натрия:
NaC104 + НС1 = НСЮ4 + NaCl
Хлорид натрия почти полностью выделяется в осадок. Во избежание взрыва применяемый перхлорат должен содержать не больше 0,5% хлорита.
При взаимодействии раствора NaC104 с 35%-ной соляной кислотой образуется раствор, содержащий около 32% НСЮ4, 8% НС1, 6% NaCl и непрореагировавшего NaC104 и 54% Н20, с плотностью 1,35 г/см3. Выделившийся в осадок NaCl отделяют от раствора фильтрованием и возвращают на электролиз для получения хлората и перхлората. Полученный раствор выпаривают в три стадии. Вначале происходит доразложение NaC104 и отгоняется хлористый водород, конденсирующийся в виде 35%-ной соляной кислоты. При этом образуется раствор, содержащий 39,5% НСЮ4, ~0,8—0,9% НС1, 7—7,5% NaCl, 52,5% Н20, с плотностью 1,395 г/см3. Во второй стадии отгоняется в основном вода, а оставшийся NaCl при повышенной температуре реагирует с НСЮ4. Раствор, выпаренный до плотности 1,58 г/см3, имеет состав: 57% НС104, ~ 0,05% НС1, 10,5% NaC104, 32,5% Н20. Его подвергают дальнейшему выпариванию при 200—270°, в процессе которого выкристаллизовывается NaC104, возвращаемый в процесс, и образуется азеотропная смесь, содержащая 72,4% НСЮ4 с температурой кипения 203°. После очистки от примесей получается продукт, содержащий 70—72% HCIO4. Безводную хлорную кислоту можно получить перегонкой 72%-ной хлорной кислоты 225 в присутствии 15—20%-ного олеума при температуре ~50° под давлением 1 мм рт. ст.
Предложено 226 в качестве стабилизирующих агентов, препятствующих разложению безводной НС104, применять низшие ке - тоны, алкилнигрилы, амиды предельных кислот и хлоропроизвод - ные этих соединений. Наибольшей эффективностью обладает 1,3-дихлорацетон.
Перспективным является непосредственное получение хлорной кислоты электролизом соляной кислоты, известное еще с конца прошлого века. В настоящее время этот процесс осуществляется электролизом водного раствора хлора в присутствии хлорной кислоты 227. При этом на аноде протекает одновременно окисление растворенного хлора, образование хлорноватой кислоты и окисление хлората в перхлорат; на катоде происходит выделение водорода. Суммарный процесс может быть представлен уравнением:
С12 + 8Н20 = 2НС104 + 7Н2
Считают 227, что прямой электрохимический способ получения хлорной кислоты может оказаться целесообразнее химического, вследствие уменьшения расхода первоначальных материалов и количества производственных стадий, потребных для образования конечного продукта. По этой же причине предпочтительнее окислять хлор в растворе хлорной кислоты, чем окислять на аноде соляную кислоту. В последнем случае имеется дополнительная электрохимическая стадия окисления иона хлора и, кроме того, раствор больше загрязнен примесями, в частности хлорноватой кислотой, которая препятствует получению в дальнейшем перхлоратов. Образование хлорной кислоты при электролизе соляной кислоты происходит при применении растворов с концентрацией 0,1 н. НС1 при плотности тока на гладком платиновом аноде 4000 а/м2. В этих условиях выход по току в расчете на хлорную кислоту составляет 40—45%. При большей или меньшей концентрации соляной кислоты, а также при меньшей анодной плотности выход по току резко уменьшается.
Для производства хлорной кислоты электролитическим окислением хлора используют 40%-ную хлорную кислоту, которую насыщают при —5° хлором, концентрация которого составляет 3 г/л. Процесс осуществляется в электролизере фильтрпрессного типа, состоящем из пяти катодов и четырех анодов. В качестве анодов применяется платиновая фольга, укрепленная на танталовой рамке, в качестве катода — серебряная пластина. Раствор подают в анодное пространство, отделенное перегородками от катодного пространства. Отбор кислоты производится из катодного пространства. Этим удается электрохимически осадить на катоде некоторое количество платины, переходящее в. раствор вследствие коррозии. Одновременно исключается возможность переноса анионов хлорной кислоты и изменения вследствие этого состава электролита.
На катоде выделяется водород, содержащий некоторое количество хлора (5—7%). Его отводят из катодного пространства; из анодного пространства отводят газообразные продукты окисления. В них содержится 25—27% хлора.
Кислота из электролизера направляется в отгонную колонну, обогреваемую паром, где она очищается от воды, хлористого водорода, образовавшегося при гидролизе хлора и непрореагировав - шего хлора. Получаемая кислота содержит 68—72% НС104.