Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
НИТРАТ КАЛИЯ204
Нитрат калия KN03 (калиевая селитра) представляет собой безводную кристаллическую соль белого цвета (иногда с желтовато - сероватым оттенком), плотностью 2,11 г/см3, плавящуюся при 334°. Выше 338° разлагается на нитрит калия и кислород. Известны две кристаллические модификации KN03: при низких температурах образуются кристаллы ромбической формы, при более высоких температурах — ромбоэдрические кристаллы 236. Растворимость KN03 в воде (в г/100 г Н20): при 20° —31,5; 30° —45,6; 40° —63,9; 60° — 109,9; 114°—312.
В растворах азотной кислоты растворимость KN03 с увеличением концентрации кислоты понижается, достигает минимума, затем возрастает; минимальная растворимость KN03 при 50° равна 24,91% при содержании в растворе 27,63% HN03 и 47,46% Н20 237.
Нитрат калия используют для производства порохов, в пиротехнике, в пищевой и стекольной промышленности и как удобрение238. К преимуществам'-нитрата калия по сравнению со многими другими удобрениями относятся: отсутствие балласта, что особенно важно при дальних перевозках и малая гигроскопичность.
|
%): |
||
|
Сорт |
Сорт |
Сорт |
|
1-й |
2-й |
3-й |
|
99,8 |
99,5 |
98,0 |
|
0,1 |
ОЛ |
2,0 |
|
0,03 |
0,1 |
Не норми |
|
Руется |
||
|
0,02 |
0.04 |
То же |
|
0,03 |
0,03 |
» » |
|
0,0 Э5 |
0,02 |
» » |
|
0,01 |
Не норми |
* * |
|
Руется |
||
|
0,02 - |
0,02 > |
» » |
Согласно ГОСТ 1949—65, к качеству калиевой селитры предъ -
KNO3 (в пересчете на сухой продукт)
Не менее........................................................................
Влага, не более...............................................................
Хлористые соли (в пересчете на NaCl) не более......................
Углекислые соли (в пересчете иа К2СО3)
Не более........................................................................
Не растворимый в воде остаток, не более Не растворимый в соляной кислоте про
Каленный остаток, не более...............................
Окисляемые вешества, не более. . .
Соли кальция и магния (в пересчете на катьций), не более
Калиевая' селитра, предназначаемая для производства порохов, должна содержать солей кальция и магния не более 0,002%.
Качество аттестованного продукта регламентировано ГОСТ 5.1138—71; он должен содержать в сухом веществе не менее 99,9% KN03; содержание примесей не должно превышать: влаги — 0,08%, хлоридов (NaCl)— 0,017%, карбонатов (К2СО3)—0,01 %, не растворимого в воде остатка — 0,01%, не растворимого в соляной кислоте прокаленного остатка — 0,004%, веществ, окисляемых мар - ганцевокислым калием (в пересчете на KN02) — 0,01%, солей Са и Mg (в пересчете на Са) —0,002%.
Способы производства нитрата калия
Нитрат калия в природе встречается в виде небольших залежей. Искусственным способом, известным с давних времен, калиевую селитру получали в так называемых селитряницах из компо - стов, в которые входили навоз, зола, известь, хворост и др. В результате биохимических процессов с течением времени в таких компостах образовывалась калиевая селитра, которую выщелачивали водой и подвергали кристаллизации; при этом получался сравнительно чистый продукт.
Получение нитрата калия нейтрализацией щелочей азотной кислотой вследствие необходимости затраты дорогого сырья — едкого кали или поташа и азотной кислоты осуществляют редко. Для нейтрализации берется 30—35% раствор КОН и 50%-ная кислота или сухой поташ, содержащий 85—87% К2С03 и около 5% КНС03, и 25—30%-ная азотная кислота. Полученный раствор, содержащий около 30% KN03, выпаривают при 110—120°, отфильтровывают от примесей на фильтрпрессе и направляют на кристаллизацию. Кристаллы отфуговывают и высушивают. •
Способ получения нитрата калия абсорбцией калиевыми щелочами нитрозных газов также применяется в ограниченных масштабах из-за дефицитности едкого кали и особенно поташа. Процесс этот аналогичен описанному выше процессу получения нитрата натрия абсорбцией нитрозных газов содой. При подаче на абсорбцию раствора едкого кали отбираемый из первой абсорбционной башни щелок содержит 350—400 г/л KN02, 80—100 г/л KN03 и 2—3 г/л КОН. Инверсия проводится при 70—80° с избытком азотной кислоты до 30 г/л
Наибольшее промышленное распространение имеет конверсионный способ получения нитрата калия. Представляет интерес получение его из окислов азота и хлористого калия.
Нитрат калия (так же как и натрия) получают с помощью катионного обмена (см. стр. 1221).
Производство нитрата калия конверсионным способом 239'244
Этот способ основан на обменном разложении NaN03 и КС1: NaN03 + КС1 = NaCl + KN03
Обменное разложение с целью получения нитрата калия может осуществляться и между другими нитратами и хлоридом, сульфатом или карбонатом калия, например:
NH4N03 + КС1 = KN03 + NH4C1
Однако в промышленности используют пока только первую реакцию.
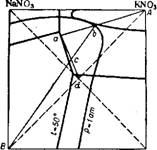
На рис. 356 изображена диаграмма растворимости в системе КС1 + NaN03 NaCl + KN03 при 5, 25, 50 и 100° 242. При низких температурах поле кристаллизации KN03 занимает большую часть площади квадрата. Если приготовить раствор эквимолекулярной смеси КС1 и NaN03 при 100°, то фигуративная точка а солевой массы. такого раствора, лежащая на пересечении диагоналей квадрата, окажется в поле кристаллизации NaCl. При выпаривании из этого раствора воды при 100°, когда будет достигнуто насыщение, начнется кристаллизация NaCl, и состав солевой массы рас
твора будет изменяться по линии Ab. В точке B раствор станет насыщенным также и К. С1. Если выделившиеся к этому моменту кристаллы NaCl отделить и затем охладить раствор, например до 5°, то точка b окажется в поле кристаллизации KN03; эта соль и будет выделяться в осадок при охлаждении, причем состав раствора будет меняться по линии be.
Так как расстояние между точками а и B невелико, то при выпаривании воды из раствора, содержащего эквимолекулярные количества NaN03 и KCI, в осадок выделяется лишь небольшое количество NaCl, и раствор вскоре становится насыщенным также и хлоридом калия. Это уменьшает и выход кристаллического KN03 при охлаждении раствора. Чтобы увеличить количество отделяемого NaCl и повысить выход KN03, как видно из диаграммы, следует вводить в исходный раствор избыток NaN03. Наибольший выход получается, если к концу выделения NaCl раствор насыщен тремя солями —NaCl, КС1 и KN03, т. е. солевая масса его изображается точкой Е2. Тогда, после отделения выделившегося NaCl, кристаллизация KNO3 при охлаждении раствора идет по наиболее длинному пути E2D, что обеспечивает наибольший выход продукта.
Для производства калиевой селитры конверсионным способом используют растворы нитрата натрия, получаемые инвертированием растворов, образующихся при щелочной абсорбции выхлопных нитрозных газов. Средний состав инвертированных растворов натриевой селитры (в г/л): 450—500 NaN03; до 4 NaHC03+Na2C03; до 1 NaN02; 1 NaCl + Na2S04.
Хлорид калия, применяемый для обменного разложения, содержит 95—98% КС 1.
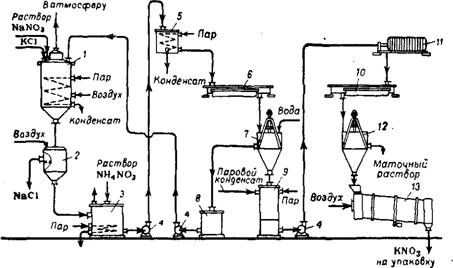
Раствор натриевой селитры предварительно фильтруют, выпаривают до содержания NaN03 600—700 г/л и затем направляют на обменное разложение (рис. 357), которое проводят в стальном реакторе 1, обогреваемом паром. В реактор постепенно вводят измельченный хлорид калия или раствор его в слабых горячих щелоках, содержащих нитрат натрия. Избыток NaN03 сверх стехиометрического количества составляет 90—120 г/л.
|
NaN03 |
|
KNOa |
|
NaCl 0,2 0,4 0,6 0,8 KCI |
|
Рис. 356. Изотермы растворимости в системе NaN03 + KCI ^ KN03+ + NaCl при 5, 25, 50 и 100°. |
Для ускорения процесса конверсии и предотвращения забивания реактора осадком хлорида натрия в нижнюю часть аппарата
Подают сжатый воздух или перемешивают раствор механической мешалкой. Благодаря интенсивному перемешиванию почти весь образующийся хлорид натрия находится в реакторе во взвешенном состоянии.
Процесс конверсии продолжается около 4 ч. В начале реакции температура раствора в аппарате 80—90°, к концу процесса ее повышают до 119—122°. Для уменьшения пенообразования в реактор
|
Рис. 357. Схема получения KN03 конверсионным способом: 1—реактор; 2—фильтр; 3— приемный бак растворов нитрата калия; 4—центробежный насос; 5 — напорный бак; 6 и 10—кристаллизаторы; 7 и 12—центрифуги; 8—сборник для первого маточного раствора; 9 — аппарат для «распарки*; // — фильтрпресс; J3 — сушильный барабан. |
Добавляют небольшое количество минерального масла. Поваренную соль отделяют от раствора на тканевых фильтрах 2, работающих под давлением 4 ат; плотность раствора перед спуском на фильтры должна составлять 1,54—1,6 г/см3. Поваренную соль, содержащую после фильтрации 15—20% KN03, промывают на фильтре холодной водой, при этом содержание KN03 в шламе снижается до 1—3%. Удаляемый из аппарата хлорид натрия можно использовать для технических целей. Раствор нитрата калия и промывные воды направляют в приемные баки 3. Во избежание кристаллизации KN03 температуру в баках поддерживают в пределах 90—105° при помощи парового обогрева. Для разложения примесей (Na2C03, NaN02) в раствор нитрата калия вводят небольшое количество нитрата аммония; при этом протекают следующие реакции:
NaSC03 + 2NH4N03 = (NH4)2C03 + 2NaNO, NaNOj + NH4N03 = NH,N02 + NaN03
Образующиеся аммонийные соли разлагаются с выделением газов, которые удаляются в атмосферу:
(NH4)2C03 = 2NH„-+ С02 + Н20 NH4N02 = N2 + 2Н20
Горячий раствор нитрата калия и промывные воды направляют в кристаллизатор 6. Здесь при охлаждении раствора до 25—30° выделяются кристаллы KN03 (первая кристаллизация). Кристаллический продукт после отделения на центрифуге 7 от маточного раствора, возвращаемого в реактор, содержит 94—96% KN03 и до 6% NaCl.
Для получения более чистой калиевой селитры (1-го сорта) кристаллический нитрат калия после первой кристаллизации обычно промывают холодной водой, растворяют в паровом конденсате («распарка») и подвергают повторной кристаллизации. Распарку проводят в аппарате 9, куда подают острый пар. Концентрированный раствор KN03, получаемый при растворении соли в паровом конденсате, отфильтровывают на фильтрпрессе 11 245 и направляют в кристаллизатор 10. Содержание NaCl в растворе перед второй кристаллизацией не должно превышать 1—2%. После отделения от маточного раствора на центрифуге 12 кристаллический нитрат калия сушат горячим воздухом (105—110°) во вращающемся барабане 13 232. Маточные растворы, получаемые после вторичной кристаллизации KN03, используют для получения калиевой селитры 2-го сорта.
На получение 1 т нитрата калия конверсионным способом расходуют: 0,93 т нитрата натрия, 0,92 т хлорида калия, 0,05 т нитрата аммония, 11 т пара; 20 м3 воды, 50 квт-ч электроэнергии.
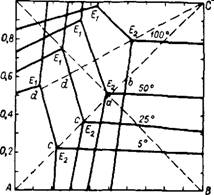
В циклическом процессе кристаллизация NaCl осуществляется во время выпаривания из системы воды при постоянном давлении и при переменной температуре. Описание и расчет реального цикла наиболее точно могут быть произведены с помощью комбинации изотермического и изобарического сечений диаграммы (рис. 358 ) 246-247. Для обеспечения возможности точного контроля и регулирования необходимо поддерживать неизменный режим процесса, что возможно лишь при работе по определенному циклу. На рис. 358 представлен пример оптимального цикла (В. Я. Рудин, Н. А. Ярым-Агаев) для случая, когда кристаллизация KN03 завершается при 50°. Точка а на изотермическом сечении характеризует состав маточного раствора после кристаллизации KN03 на отрезке Ьа в процессе охлаждения. В начале кристаллизации солевому составу раствора соответствует точка Ь. Перед кристаллизацией к нему добавляют такие количества воды, чтобы он насытился хлоридом натрия лишь при заданной температуре конца кристаллизации (50°). Раствор Ь получается в результате выпаривания воды и кристаллизации NaCl из кипящего раствора с. Точка с
принадлежит к изобарическому сечению диаграммы и лежит на луче выпаривания Bcb. Исходный раствор для выпаривания с получается при смешении маточного раствора а с эквимолекулярной смесью D KCl и NaN03. Таким образом цикл осуществляется по треугольнику Cba. Чем выше солевой коэффициент цикла (т. е. отношение массы полученного KN03 к массе выпаренной воды), тем меньше расход энергии на выпаривание. Чем выше конечная температура кристаллизации KN03, тем меньше затраты на охлаждение раствора. Наиболее экономичными являются циклы с темпера -
|
KCl |
|
Nh4No3 |
|
Kno. |
|
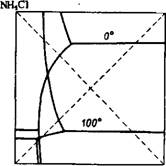
Рис. 359. Изотермы растворимости в системе NH4N03 + + KCl KN03 + NH4C1 при 0 и 100°. |
|
NaCl Рис. 358. Оптимальный цикл конверсии KCl + NaN03 = =KN03 + NaCl в диаграмме с изотермическим (50°) и изобарическим (1 ат) сечениями. |
|
KCl |
Турными интервалами от точки кипения до конечной температуры кристаллизации в пределах 50—25°. При этом для луча упаривания Bb оптимальные отношения К+: N03 находятся в пределах 0,69—0,96 — они обеспечивают сравнительно высокие солевые коэффициенты и небольшие объемы циркулирующих растворов.
Представляет интерес получение нитрата калия обменным разложением хлорида калия и нитрата аммония 248'249.
В качестве побочного продукта в этом случае получается хлорид аммония, т. е. продукт более ценный, чем поваренная соль, образующаяся при обменном разложении хлорида калия и нитрата натрия.
Диаграмма растворимости в системе NH4N03 + KCl = KN03 +' 4- NH4CI (рис. 359) показывает, что поле кристаллизации KN03 сильно увеличивается при понижении температуры. Поэтому легко подобрать условия, обеспечивающие кристаллизацию большей части KN03 при охлаждении концентрированного раствора, полуденного смешением NH4N03 и КС1, Использование этого способа
затрудняется необходимостью после выделения KN03 выпаривать раствор хлорида аммония, интенсивно разрушающий выпарные аппараты, кроме того, потребность в хлориде аммония относительно невелика; как удобрение хлорид аммония имеет весьма' ограниченное применение.