Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Кристаллизация сульфата кальция
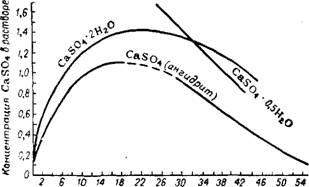
В системе CaO—Р2О5—S03—Н20 сульфат кальция в твердом виде может существовать в трех формах: ангидрита CaS04, полугидрата CaS04 • 0,5Н20 и дигидрата или гипся CaS04-2H20. Растворимость гипса и ангидрита возрастает с увеличением концентрации кислоты до определенной величины, а затем убывает (рис. 243, 244).
При 80° в диапазоне концентраций кислоты 0—50% Р2О5 стабильной формой, обладающей наименьшей растворимостью, является ангидрит46'64, а при 25° в растворах, содержащих до ~30% Р2О5, — дигидрат. Наличие при этих условиях других форм сульфата кальция обусловлено длительностью скрытого периода их
|
В (Л ° , СК W О"? р" о Б о T а 0,2 |
|
В 16 20 32 4 0 48 56 64 Концентрация P2Os, % Рис. 243. Растворимость кристаллогидратов сульфата кальция в водных растворах фосфорной кислоты при 25°. |
Перехода в стабильную форму, соответствующей большей или меньшей устойчивостью образующегося метастабильного или пересыщенного раствора (по отношению к стабильной фазе). Во всех случаях образования сульфата кальция в фосфорнокислых растворах вначале выделяется полугидрат, который затем превращается в стабильную при данных условиях форму. Это превращение происходит путем растворения полугидрата и одновременной кристаллизации из раствора гипса или ангидрита. В системе CaS04— —Р2О5—Н20 гипс является стабильной формой сульфата кальция только в растворах фосфорной кислоты, над которыми давление водяного пара больше давления пара над твердым CaS04-2H20 при данной температуре.
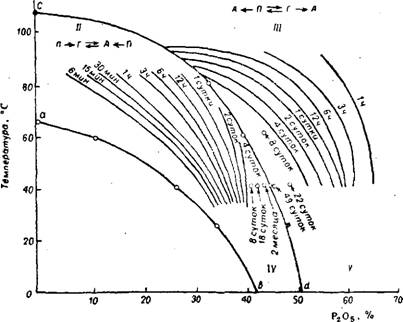
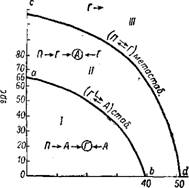
На рис. 245 приведена схема превращения кристаллогидратов сульфата кальция в чистых растворах фосфорной кислоты в зависимости от их температуры и концентрации. В области выше cd стабильной формой является ангидрит. При 80° превращение первоначально выделившегося полугидрата в ангидрит происходит в растворах, содержащих больше 33,3% Р2О5 (рис. 245). Если в растворы, составы которых расположены выше Cd, внести гипс, то он сначала превращается в метастабильный полугидрат, имеющий
|
Концентрация сроссрорной кислоты, %P2Os Рис. 244. Растворимость кристаллогидратов сульфата кальции в водных растворах фосфорной кислоты при 80°. |
Меньшую растворимость, чем гипс, а затем в ангидрит. В области между кривыми Cd и Ab стабильной формой также является ангидрит, но здесь полугидрат превращается в ангидрит не непосредственно, а сначала переходит в гипс, который отличается промежуточной растворимостью. При 80° это происходит в растворах, содержащих от 0 до 33,3% Рг05 (рис. 245), что объясняется одинаковой растворимостью полугидрата и дигидрата при 80° и 33,3% Р205. Пересечение кривых на рис. 244 отвечает сосуществованию в растворе двух метастабильных фаз — полугидрата и дигидрата при 80°, и кривая Cd (рис. 245) представляет собой геометрическое место точек сосуществования этих метастабильных фаз при разных температурах.
В области ниже Ab стабильной формой является гипс. Кривая Ab— линия, разграничивающая растворы, равновесные со стабильными твердыми фазами—ангидритом и гипсом. Она представляет собой также геометрическое место точек сосуществования метастабильного и стабильного дигидрата. В растворах, соста
Вы которых расположены ниже кривой Ab, ангидрит непосредственно переходит в гипс (рис. 245), а полугидрат предварительно претерпевает дегидратацию, переходя в ангидрит.
Превращение метастабильных фаз, связанное с уменьшением концентрации сульфата кальция в пересыщенном (метастабиль - ном) растворе и переходом его в стабильное состояние, зависит не только от температуры и концентрации кислоты, но и от свойств кристаллогидратов. В области выше кривой Cd превращение метаста - so бильного полугидрата в стабильный и ангидрит происходит очень медлен - о но, в течение многих суток. Процесс | ускоряется с повышением темпера туры и увеличением концентрации f кислоты. Например, при 60° это пре- £ вращение в кислоте концентрации 50% Р2О5 завершается примерно за 10—12 суток, а при 90° — за 1 сутки. В кислоте, содержащей 40% Р2О5, для перехода полугидрата в ангидрит при 90° требуется ~2 суток.
В области между кривыми Cd и аЪ превращение метастабильного полугидрата в метастабильный гипс в растворах, содержащих 10—25% Р2О5, при 80° происходит в течение 1—8 ч ^.табл. 70). Процесс ускоряется с понижением температуры. и уменьшением концентрации кислоты. Дальнейшее превращение гипса в стабильный ангидрит протекает очень медленно. Образовавшийся в этих условиях гипс существует в метастабильной форме в Течение нескольких месяцев (при концентрации Р205 ниже 10%) или нескольких суток (при 25% Р2О5).
На рис. 246 показаны изохроны скрытых периодов перехода полугидрата в гипс и ангидрит, а на рис. 247 — изохроны кристаллизации гипса и ангидрита.
|
110 /07 100 |
|
20 30 |
|
Рго5, % Рис. 245. Схема превращений кристаллогидратов сульфата кальция в растворах фосфорной кислоты при различных температурах: / область. Стабильная форма —гипс; схема превращений: полугидрат (Я) —>■ —>■ ангидрит (А) —> гипс (Г) и ангидрит —->• гипс, //область. Стабильная форма —ангидрит; схема превращений; полугндрат —> —>■ гипс —> ангидрит и гипс —-> ангидрит. III область. Стабильная форма — ангидрит; схема превращений; полугидрат —»■ —>■ ангидрит и гипс —> полугидрат —>■ —>■ ангидрит. |
Присутствие в кислоте примесей влияет на растворимость кристаллогидратов и в соответствии с этим изменяются устойчивость метастабильных фаз и условия сосуществования их и стабильных фаз. В растворах фосфорной кислоты, содержащих свободную серную кислоту или избыточное количество окиси кальция по сравнению со связанной в виде CaS04, растворимость сульфата кальция
|
ТАБЛИЦА 70
|
|
|
|
Продолжительность превращения полугидрата в гипс в зависимости от температуры и концентрации фосфорной кислоты |
Рнс. 246. Изохроны скрытых периодов перехода полугидрата в гипс и ангидрит в фосфорнокислых растворах.
Значительно уменьшается 65-68. Фосфат кальция оказывает высаливающее действие на сульфат кальция. При увеличении содержания свободной СаО в растворе до 1,5—2% возможна совместная кристаллизация сульфата и фосфата кальция. Указывают также на возможность образования 69,70 в этих условиях твердого раствора CaS04-2H20 и СаНР04*2Н20. Увеличение концентрации
|
Р2О5,УС Рис. 247. Изохроны кристаллизации гипса и ангидрита в фосфорнокислых растворах. |
Свободной серной кислоты в растворах фосфорной кислоты, содержащих 25—35% Р205, при 70° приводит к уменьшению растворимости как полугидрата, так и дигидрата сульфата кальция71. В растворах фосфорной кислоты, содержащих кремнефтористоводо - родную кислоту, растворимость сульфата кальция, наоборот, увеличивается.
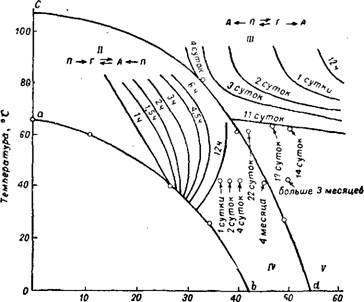
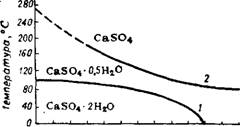
Отношение СаО : S03 в сульфате кальция равно 0,7. При избытке СаО в растворе сверх этого отношения, а также в присутствии солей магния область стабильной кристаллизации гипса расширяется 29,72-74 до концентрации жидкой фазы 35—37% Р205 при температуре соответственно 80—70°. На рис. 248 изображена диаграмма, показывающая практическую (в пределах длительности технологических процессов и содержащихся в растворе примесей)
степень гидратации сульфата кальция в зависимости от температуры и концентрации производственной фосфорной кисло - ты 25,75-77 в условиях, близких к производственным, значительно расширяется область существования стабильного гипса и появляется достаточно широкая область существования устойчивого полугидрата.
На практике осаждение стабильного гипса (дигидратный процесс) ведется в условиях получения фосфорной кислоты с концентрацией до 30—32% Р2О5 при 65—80°. Из более концентрированных растворов (> 35% Р205) и при повышении температуры до 90—95° осаждается полугидрат, в различной степени способный к оводнению до гипса 72~79. Снижение температуры осаждения и концентрации фосфорной кислоты, а также повышение количества СаО или S03 в растворе способствует получению быстро оводняющегося полугидрата. Присутствие большого количества гипса (затравки) тоже ускоряет превращение полугидрата.
При температурах выше 100—105° и концентрации кислоты больше ~45% Рг05 (рис. 248) выделяется ангидрит.
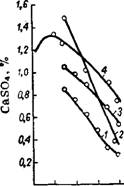
Форма и размеры выделяющихся кристаллов зависят от температуры и концентрации кислоты, степени пересыщения и условий снятия пересыщения. Установлено81 максимальное пересыщение (при котором начинается самопроизвольная кристаллизация) сульфатом кальция растворов системы CaS04—Р2О5—Н20 при 25, 60 и 80°. Кривые пересыщения фосфорнокислых растворов сульфатом кальция в зависимости от концентрации кислоты располагаются симбатно кривым растворимости гипса и ангидрита (рис. 249). Значения концентрации пересыщения растворов сульфатом кальция не только превышают значения растворимости стабильной формы, но существенно отличаются от растворимости метастабильных форм. Например, для 45% Р205 при 60° концентрация сульфата кальция в пересыщенном растворе равна ~ 0,9%, в то время как растворимость ангидрита составляет 0,32, полугидрата—0,58 и гипса—0,69% CaS04.
|
5 10 15 20 25 30 35 40 4S SO 55 60 Р*о 6,7. |
|
Рис. 248. Области существования кристаллогидратов сульфата кальция в условиях производства фосфорной кислоты серноКислотным методом. |
На рис. 250 представлена кривая изменения во времени концентрации сульфата кальция в пересыщенном растворе (в расчете на СаО), содержащем 45,6% Р205 в отсутствии других посторон
них ионов при 60°. В данных условиях стабильной твердой фазой является ангидрит, гипс — первой метастабильной фазой, а полугидрат — второй. Как видно, при переходе от первой метастабильной фазы дигидрата к другой наблюдается как бы вторичное пересыщение раствора (максимум на кривой). С увеличением содержания Рг05 в пересыщенных растворах в диапазоне от 10 до 50% Р205 скорость кристаллизации сульфата кальция при 25° уменьшается, а при 60° —- увеличивается.
Размеры выделяющихся кристаллов сульфата кальция при различных условиях изучены в большей мере при образовании дигидрата и в меньшей — при образовании полугидрата и ангидрита. Установлено81, что при выделении гипса из чистых фосфорнокислых

|
Гипс |
|
Полугидрат |
Г* СИг
О
§ 0.3 =г 0,276
О. 0,238 S
£ 0.2
3"
|
20 30 40 50 ВО Рго5,% |
|
Рис. 249. Изотермы 60° растворимости сульфата кальция и пересыщения им растворов в системе CaS04—Н3РО4—Н20: I — ангидрит; 2 — полугидрат; 3 —гипс; 4 — пересыщение сульфатом кальция. |
T
5
3 5 7 9 Время, V
11 13
Рис. 250. Изменение во времени концентрации сульфата кальция (в пересчете на СаО) в пересыщенном растворе, содержащем 45,6% Р206 при 60°.
Растворов повышение температуры от 30 до 80° приводит к увеличению длины кристаллов в 10—15 раз, а ширины в 3—5 раз. С изменением концентрации кислоты от 25 до 34% Р205 продольные и поперечные размеры кристаллов значительно уменьшаются. Большое влияние на форму кристаллов оказывают примеси 82~87. Увеличение содержания СаО в реакционной пульпе вызывает уменьшение размеров кристаллов при возрастании степени неоднородности их81. Некоторое уменьшение размеров кристаллов наблюдается при большом недостатке или избытке серной кислоты по сравнению со стехиометрическим ее количеством. Максимальные размеры кристаллов соответствуют норме серной кислоты 90 и 110% по отношению к стехиометрической. На рост кристаллов
Гипса оказывает влияние соотношение между концентрациями ионов Са2+ и S024" в растворе.
При избытке Са2+ гипс образуется в виде тончайших игл длиной 20—80 мк. По мере уменьшения концентрации Са2+ и увеличения концентрации SO?" кристаллы гипса растут; при избытке Soil- их размеры достигают 100 мк в ширину и нескольких сотен микронов в длину. Для получения крупнокристаллического однородного осадка необходимо, чтобы отношение S03: СаО в жидкой фазе (по весу) было по возможности постоянным, # равным 1,5—3. Оптимальным является содержание в растворе 1—2,5% S03 и 0,35—0,75% СаО.
При небольшой концентрации S03 примеси ионов трехвалентного железа и алюминия способствуют образованию более широких и коротких (изометрических) кристаллов гипса и полугидрата. Влияние этих примесей на размеры выделяющихся кристаллов имеет сложный характер88. Образование кристаллов по форме, близкой к изометрической, происходит при содержании в растворе от ~0,2 до 1,5% R203. Это обусловливается уменьшением длины кристаллов почти в 1,5 раза; ширина же их остается практически неизменной.
В сочетании с ионами алюминия благоприятное влияние на форму и размеры кристаллов сульфата кальция оказывают ионы кремнефторида. Хорошо фильтрующий сульфат кальция образуется в присутствии 1—2% (по отношению к Рг05—фосфата) сульфатов магния, цинка, железа, никеля и меди 89. При наличии в растворе большого количества кремневой кислоты гипс кристаллизуется в виде тончайших игл. Кроме того, выделившаяся при экстракции фосфорной кислоты из некоторых фосфоритов кремневая кислота в виде илистого осадка сильно затрудняет отделение жидкой фазы от твердой.
О размерах кристаллов полугидрата и ангидрита, выделяющихся из концентрированных растворов фосфорной кислоты при повышенных температурах, имеются весьма ограниченные сведения. Известно,90 что полугидрат и ангидрит, выделяющиеся при высокой температуре в фосфорнокислой среде с большим содержанием Р2О5, хорошо отфильтровываются от жидкой фазы. В этих условиях полугидрат кристаллизуется в форме небольших шестигранных призм размером 20—30 мк, собранных в крупные конгломераты, а ангидрит — в виде широких утолщенных пластинок. Крупные компактные конгломераты кристаллов полугидрата получены из раствора, содержащего 40% Р2О5, при небольшой концентрации (1,5—1,7%) S03. Они отделяются от раствора лучше, чем тонкие пластины или игольчатые кристаллы. Ангидрит, наоборот, выделяется в виде более крупных кристаллов, образующих пластины
Неправильной квадратной формы, из раствора концентрации 45—55% Р2О5, содержащего избыток серной кислоты (3—5% S03).
При длительности процесса 4—6 ч из растворов, содержащих 35—43% Р205 при 75—80°, выделяющиеся конгломераты полугидрата имеют размер от 75 до 200—300 мк; они состоят из отдельных мелких кристаллов ~10мк. Размеры кристаллов полугидрата зависят как от концентрации кислоты, так и от плотности пульпы.91 При весовом отношении Ж : Т в пульпе в пределах от 6:1 до 10:1, концентрации кислоты ~50% Р2О5 образующиеся при 60° кристаллы полугидрата имеют длину от 50 до 80 мк и ширину от 3 до Ъмк. Размеры кристаллов полугидрата, выделяющиеся при 60° из раствора фосфорной кислоты концентрации 45% Р205 при Ж : Т « 4 : 1, составляют 40—50 мк по длине и 3—4 мк По ширине.
Полученные в лабораторных условиях (периодический метод) кристаллы полугидрата не собираются в конгломераты и имеют игольчатую форму. Длина их превышает ширину примерно в 10 раз. Такие кристаллы легко отфильтровываются от жидкой фазы, но задерживают относительно большие количества кислоты, что приводит к значительным потерям Р2О5 при промывке.
Кристаллы полугидрата с размерами в длину до 150 мк и в ширину до 15—20 мк выделяются 92 в фосфорнокислом растворе, содержащем ~ 25—33% Р205 и 15—25% HN03. Такие кристаллы отделяются фильтрованием от раствора, представляющего собой смесь азотной (~50% HN03) и концентрированной фосфорной кислоты (~45—65% Р2О5), со скоростью в 3—6 раз большей, чем дигидрат в производстве кислоты концентрации 30—32% Р2О5.
Образование кристаллов ангидрита связано с дегидратацией первоначально выделяющегося полугидрата. В растворе, содержащем 50% Р205, при 90° перекристаллизация начинается только через 6 ч и заканчивается после 30 ч (стр. 897). Дегидратация полугидрата ускоряется с увеличением концентрации P2Os, а также при наличии в растворе серной кислоты. С повышением концентрации свободной H2S04 в растворе скорость дегидратации полугидрата возрастает и образующиеся кристаллы ангидрита имеют относительно небольшие размеры93. Так, в кислоте, содержащей в растворе 47—50% Р205 и больше 5% H2S04, дегидратация при 100° заканчивается в течение 20—40 мин. Образующиеся кристаллы ангидрита имеют прямоугольную форму и длину 15—30 мк, а ширину— 6—10 мк. С понижением концентрации серной кислоты до 3% продолжительность полного превращения полугидрата при 100° увеличивается до 80—85 мин. При этом получаются значительно более крупные кристаллы, имеющие также прямоугольную форму, с размерами, например, 30—40 X 6—8 мк. В этих условиях заметное растворение полугидрата начинается только через ~ 30 мин После начала процесса, а появление первых кристаллов ангидрита —■ через 40 мин. Это указывает на образование раствора с относительно небольшим пересыщением ангидритом, что обусловливает выделение более крупных кристаллов.
Дальнейшее уменьшение содержания серной кислоты в растворе до 2—1 % H2SO4 связано с уменьшением нормы ее до 100 и 90% по отношению к стехиометрическому количеству (в расчете на кальций) и накоплением в растворе ионов кальция. В этом случае выделяются мелкие и неразвитые по форме кристаллы ангидрита, хотя фазовый переход протекает очень медленно. Для полного превращения полугидрата в ангидрит в этом случае требуется в зависимости от нормы кислоты от 150 до 600 мин.
С повышением температуры дегидратация полугидрата сульфата кальция ускоряется, и соответственно уменьшаются размеры кристаллов ангидрита. Это, вероятно, объясняется увеличением скорости растворения полугидрата при повышении температуры и достижением в результате этого большего пересыщения раствора сульфатом кальция. При 120° в растворе, содержащем 3—3,5% H2SO4, продолжительность процесса меньше в 2—3 раза, чем при 100°, и составляет 30—40 мин вместо 80—120 мин.
При увеличении содержания в пульпе жидкой фазы степень пересыщения раствора сульфатом кальция при прочих равных условиях (растворимости, скорости перемешивания и др.) уменьшается. Это должно привести к замедлению дегидратации и увеличению размеров выделяющихся кристаллов ангидрита. При содержании в растворе ~3-7,5%SOih Ж:Т = 6:1 и 80—100° выделяющиеся кристаллы ангидрита имеют размеры от 30X6 мк До 60 X 15 мк.