Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
КОНЦЕНТРИРОВАННЫЕ ФОСФОРНЫЕ УДОБРЕНИЯ. ПРЕЦИПИТАТ(ДИКАЛЬЦИЙФОСФАТ)
Преципитатом называют фосфорное удобрение, содержащее до 40% Р2О5 в цитратнорастворимой форме; основной его компонент— двухводный дикальцийфосфат СаНР04-2Н20. Преципитат получают в виде порошка белого (или кремового) цвета осаждением (преципитированием) из фосфорнокислых растворов известковым молоком или водной суспензией измельченного известняка и последующими отфильтровыванием, сушкой и измельчением.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Дикальцийфосфат может существовать в виде монетита СаНРС>4 (триклинные кристаллы с плотностью 2,89 г/см3) и бру - шита СаНР04-2Н20 (моноклинные кристаллы с плотностью 2,31 г/см3).
В системе СаО—P2Os—Н20 ниже 36° стабилен брушит, при более высокой температуре — монетит 1_5. При 40—50° брушит осаждается как метастабильная фаза. При более высокой температуре выделяется безводная соль6-9.
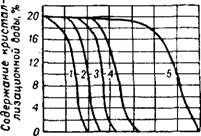
На рис. 296 показана растворимость 10 метастабильной фазы СаНР04-2Н20 и стабильной СаНР04 при 40°, а на рис. 297 скорость полиморфного превращения СаНР04 • 2Н20 —> СаНР04 при этой же температуре. Метастабильный брушит превращается в стабильную безводную соль тем скорее, чем выше концентрация Р205 в жидкой фазе. Потеря кристаллизационной воды при фазовом превращении брушита в растворах вызывает заметное (до •50 отн. %) уменьшение количества усвояемой (цитратнорастворимой) Р205 в продукте 10' и.
При очень малых концентрациях Р2О5 (рН раствора от 6,4 до 8,0 и выше) в твердой фазе системы СаО—P2Os—Н20 появляются
Более основные фосфаты (рис. 298)3,5'12, с чем также связано понижение усвояемости продукта.
|
25 |
|
СаНР04 |
|
T |
|
10 20 30 40 50 60 г Время, ч |
|
Рис. 297. Фазовое превращение СаНР04 • 2Н20 в безводную соль при 40° в зависимости от концентрации Р205 в жидкой фазе, равновесной с двуводной солью. Концентрация Р205: 1- 18%: 2-16%; 3-Н%; 4-12%: 5— ЮЖ. |
|
CaHP04- 2HjO |
|
/ |
Температура и скорость дегидратации брушита при сушке зависит от давления, величины кристал -
20
15
О £
10
А
О
2 4 6 СаО, %
Рис. 296. Растворимость метастабильиой фазы
|
30 |
|
Са(Нгр64)гнгСЛ |
СаНР04-2Н20 и стабильной фазы СаНР04 в системе СаО—Р205—Н20 при 40°.
Лов, способов осаждения и т. д., поэтому имеющиеся данные раз -
/. норечивы 10' 13~16. Под атмосфер -
С нро -2н о ньш давлением заметное обезво -
4 г живание брушита наблюдается при
Нагревании в течение 1 ч до 100° / и выше10. Дегидратация брушита
/Са,(РО,)д сушкой снижает содержание усвояе -
|
400 300 200 |
|
Ю0 50 30 10 |
' мой Р205 только на 10 отн. %,
Т. е. в меньшей степени, чем при.
J 1. с. о меньшей степени, чем ар*
|
152050 200 400600 1000 1200 СаО, иг/л |
|
Рис. 298. Система СаО—Р206—Н20 при 25° в области низких концентраций3. |
./ЗСа3(РО<)1Са(он), _ ,, фазовом превращении через рас V...... хвор.
Нагревание дикальцийфосфата до 175° и выше вызывает отщепление конституционной воды с образованием неусвояемого пирофосфата кальция 13. Технический преципитат (кормовой и удобрительный) содержит от 35 до 50% Рг05 общей и от 33 до 48% Р205 усвояемой (цитратнорастворимой). При переработке фосфоритов
Каратау преципитат содержит от 3 до 8% водорастворимой
Преципитат обладает малой гигроскопичностью (при 7,5-% влажности гигроскопическая точка равна 84%, балл по шкале Пе - стова 1,2)17. Он хорошо рассевается только при очень небольшой (до 1%) влажности; при влажности 9% преципитат совершенно не способен рассеваться (табл. 81). Объемный вес его18 равен 0,86— 0,87 т/м3.
Димагнийфосфат с 2% влаги не гигроскопичен даже при 100%-ной относительной влажности воздуха, поэтому его присутствие в преципитате улучшает физические свойства продукта.
ПРИМЕНЕНИЕ
В качестве удобрения преципитат обладает многими достоинствами 19~23: высокая концентрация усвояемой Р2О5, одинаковая с суперфосфатом агрохимическая эффективность на всех типах почв и для всех культур, уменьшение почвенной кислотности при его применении на кислых почвах. Преципитат нейтрален, поэтому не разрушает тару. Он пригоден для получения смешанных и сложных удобрений. Сравнительно высокая стоимость преципитата ограничивает его применение как удобрения. Фосфорную кислоту, получаемую термическим способом или сернокислотной экстракцией фосфатов, выгоднее перерабатывать в двойной суперфосфат, производство которого проще, не требует затраты извести и громоздких операций для ее приготовления. Стоимость усвояемой Р2О5 в двойном суперфосфате меньше примерно в 2,2 раза, чем в преципитате. Поэтому преципитат получают обычно лишь из фосфорнокислых растворов, являющихся отходами других производств 24-32.
Технический преципитат в различной степени загрязнен примесями фосфатов, магния, железа и алюминия, сульфатами и карбонатами кальция, кремнефторидами и др. Фосфаты полуторных окислов, присутствующие в удобрительном преципитате, примерно в 2 раза менее эффективны, чем дикальцийфосфат, хотя они и растворяются в цитратном растворе 19. Поэтому необходима очистка фосфатного сырья от полуторных окислов.
|
ТАБЛИЦА 81 Рассеваемость и угол откоса преципитата |
|
Влажность, % |
Рассеваемость по шкале Пестова |
Угол откоса |
|
1,0 |
5,9 |
44° 15' |
|
5,0 |
1,5 |
40°10' |
|
7,0 |
1,1 |
46° 50' |
|
9,0 |
0 |
47°50' |
Согласно ГОСТ 1175—41, удобрительный преципитат, получаемый на основе сернокислотного разложения природных фосфатов, должен содержать не менее 31% (в I сорте) и 27% (во II сорте) цитратнорастворимой Р205 и не более 10% влаги; остаток на сите 2 мм не более 1,5%.
Преципитат применяют в СССР и за рубежом в небольших количествах в качестве кормового средства, как минеральную добавку к корму сельскохозяйственных животных24. В кормовом преципитате должны отсутствовать вредные для здоровья животных примеси. В частности, содержание мышьяка не должно превышать 0,001% и фтора —0,2—0,3%.
Мировое производство преципитата 33>34 составляет около 500 тыс. т в год.
МЕТОДЫ ПРОИЗВОДСТВА
Производство преципитата состоит из двух'стадий36_49: 1) получения раствора, содержащего фосфорную кислоту, и 2) осаждения дикальцийфосфата (преципитирование).
Исходным раствором для получения преципитата служит фосфорная кислота и различные фосфорнокислотные растворы, например, образующиеся в качестве отхода в производстве желатины на костеобрабатывающих заводах. Перед переработкой органического вещества обезжиренных костей в желатин их обрабатывают 2—5%-ной соляной кислотой для растворения основного вещества кости — трикальцийфосфата. Образующийся при этом фосфорнокислый раствор, содержащий монокальцийфосфат и хлорид кальция, подвергают преципитированию.
Небольшие количества преципитата вырабатывают на некоторых суперфосфатных заводах50 из отбросных солянокислых растворов с концентрацией 4—4,5% НС1, получаемых при переработке кремнефтористоводородной кислоты в кремнефторид натрия (стр. 1142). Образуется разбавленный фосфорнокислый раствор Ca5(P04)3F + 10НС1 = ЗН3РО4 + 5СаС12 + HF
Который преципитируют. Содержащийся в растворе хлорид кальция не участвует в образовании осадка дикальцийфосфата, но высаливает его из раствора. При получении фосфорнокислых растворов из фторсодержащего сырья перед преципитированием из раствора осаждают кремнефторид натрия. При переработке апатитового концентрата целесообразно выделение также фосфатов редких земель.
Различия в методах осаждения преципитата зависят преиму-' щественно от концентрации Р2О5 в исходных растворах, от вида осадителя — суспензии известняка, известкового молока или же последовательно того и другого, — а также от назначения готового продукта. Схемы осаждения кормового преципитата определяются составом начальных растворов. Из чистых растворов (из очищенной фосфорной кислоты, полученной электротермическим способом, или из отходящих растворов производства пищевой желатины) дикальцийфосфат осаждается в одну ступень. Экстракционную фосфорную кислоту нейтрализуют в две ступени: в первой осаждается дикальцийфосфат, загрязненный фосфатами полуторных окислов и другими примесями, во второй — более чистый продукт. Удобрительный преципитат осаждают в одну ступень суспензией известняка, известковым молоком или последовательно тем и другим.
Концентрация Р205 в исходном растворе определяет необходимость предварительной декантации преципитатной пульпы, возможность прямого ее фильтрования или же непосредственного высушивания с ретурным продуктом.
Предложены разные способы переработки преципитатной пульпы или смеси фосфорной кислоты с известняком непосредственной сушкой ее без предварительного фильтрования. Преципитатную пульпу, полученную 51>52 взаимодействием фосфорной кислоты с суспензией известняка в количестве 80—90% от стехиометрической нормы СаО на образование СаНР04, смешивали с ретуром сухого продукта до содержания 30—32% влаги и высушивали при температуре не выше 90°. Готовый продукт из обесфторенной кислоты с концентрацией 22% Р2О5, полученной из фосфорита Каратау, содержал около 33% усвояемой Р2О5, в том числе 8% водорастворимой Р2О5. Из актюбинского фосфорита подобным методом получали продукт с содержанием до 42% усвояемой Р2О5, в том числе 12—20% водорастворимой Р2О5.
При непосредственном образовании преципитата из фосфата и серной кислоты по реакции
Ca5(P04)3F + 2H2S04 = 2CaS04 + 3CaHP04 + HF
Расход кислоты меньше, чем при получении не только экстракционной кислоты, но и простого суперфосфата. В этом случае стоимость единицы усвояемой Р205 в преципитате была бы ниже, чем в других удобрениях. Однако реакция образования преципитата по указанному уравнению протекает в очень малой степени и практически в прямом виде неосуществима. В связи с этим предложены различные циклические методы, позволяющие в конечном итоге получить преципитат с указанным расходом серной кислоты. В качестве циркулирующих реагентов могут быть использованы как легко летучие кислоты — азотная или соляная, так и фосфорная кислота. При этом в большинстве методов исключается также операция преципитирования и, следовательно, расход извести или известняка и другие затраты.
Получение преципитата сернокислотным разложением фосфатов с циркуляцией азотной (или соляной) кислоты аналогично получению таким методом двойного суперфосфата (стр. 1008). Процесс может быть представлен53 следующей схемой. Разложение фосфата (апатита) осуществляюг смесью серной и циркулирующей азотной кислоты:
Ca6(P04)3F + 2H2S04 + 6HN03 = 2CaS04 + 3Ca(N03)2 + 3H3P04 + HF
При этом расход серной кислоты меньше на ~40% (2 моль Вместо 3,5 моль на 1 моль апатита), чем в производстве простого суперфосфата. После отделения сульфата кальция раствор смешивают с ретуром готового продукта и высушивают. При этом образуется преципитат, а выделяющиеся пары азотной кислоты конденсируются и возвращаются в процесс в виде раствора:
Ca(N03)2 + Н3РО4 = СаНР04 + 2HN03
В лабораторных условиях образование дикальцийфосфата из раствора, смешанного с ретуром (0,75—1 вес. ч. дикальцийфосфата на 1 вес. ч. раствора) при 120—150° практически заканчивается в течение 30 мин. Полученный продукт содержит 1,5—3,5% влаги, 43—50% общей Р2О5, в том числе 40—45% Р2О5, растворимой в 4%-ном растворе соляной кислоты.
Аналогично при использовании циркулирующей соляной кислоты 54>55 получают вначале раствор с эквимолекулярным содержанием Н3РО4 и СаС12, из которого затем удаляют хлористый водород при температуре около 128°:
Н3Р04 + СаС12 = 2НС1 + СаНР04
Хлористый водород поглощают водой и образующуюся соляную кислоту возвращают на разложение фосфата. В этом процессе количество циркулирующей соляной кислоты может быть уменьшено примерно в 2 раза, если вместо раствора хлорида кальция в фосфорной кислоте подвергнуть разложению монокальцийхлор - фосфат — СаС1Н2Р04 или СаСЬ • Са(Н2Р04)2 в виде двух - или од - новодной соли при 225—300° в присутствии водяного пара:
СаС1Н2Р04 = СаНР04 + НС1
Монокальцийхлорфосфат выделяется в твердую фазу разложением фосфатов при 25° концентрированной соляной кислотой 56_6°, содержащей больше 20% НС1:
Ca5(P04)3F + 7НС1 = ЗСаС1Н2Р04 + 2СаС12 + HF
При этом в маточном растворе остается хлорид кальция и соляная кислота полностью не регенерируется. Осуществление процесса в замкнутом цикле возможно при разложении природного фосфата циркулирующим газообразным хлористым водородом с добавкой фосфорной или серной кислоты59 по схемам:
«СаО • Р206 + иНС1 + (п - 2)Н3Р04 + ЗН20 = иСаС1Н2Р04 • Н20
ИЛИ
FtCaO • Р205 + 2НС1 + (п - 2)H2S04 + (5 - и)Н20 = = 2СаС1Н2Р04 • Н20 + (ft - 2)CaS04
Где п — молярное отношение СаО : Р205 в природном фосфате.
Образовавшийся моиокальцийхлорфосфат разлагают при нагревании, при этом хлористый водород почти полностью регенерируется.
В этих способах на превращение фторапатита в дикальцийфосфат теоретически расходуется в 2,5 раза меньше ионов водорода кислот, чем по обычной схеме, и совсем не расходуется известь и известняк. Необходимость термической обработки при температурах, превышающих 100°, вероятно, затруднит получение удобрительного преципитата удовлетворительного качества по содержанию цитратнорастворимой Р2О554. Для кормового продукта это не имеет большого значения.
Более сложным представляется получение дикальцийфосфата преципитированием фосфорной кислоты природным фосфатом 2Н3Р04 + Ca5(P04)3F = 5СаНР04 + HF
Или с использованием фосфорной кислоты, образующейся (регенерируемой) при реакции гидролиза монокальцийфосфата: Са(Н2Р04)2 • Н20 + Н20 = СаНР04 • 2Н20 + Н3Р04
Продукт, содержащий СаНР04, можно получить путем прямого взаимодействия 61 фосфорита, фосфорной кислоты и воды в автоклаве под давлением 7 ат при 200°.
Для разложения фосфорита фосфорной кислотой, образующейся при гидролизе монокальцийфосфата 62 в дикальцийфосфат63, последний отделяют фильтрованием от разбавленной фосфорной кислоты, которую концентрируют и используют для разложения фосфорита.
В других работах 64-66 фосфорит смешивали с монокальций - фосфатом и водой или же с фосфорной кислотой и водой (в этом случае соотношение такое, чтобы только часть фосфорита превращалась в монокальцийфосфат). Смесь нагревали сначала в аппарате с обратным холодильником де температуры около 110° для ускорения гидролиза монокальцийфосфата, а затем в открытом аппарате до 185°. Образовавшаяся при этом в результате гидролиза фосфорная кислота концентрировалась и реагировала с фосфоритом. Источником монокальцийфосфата может служить простой или, лучше, двойной суперфосфат. Для более полного разложения фосфорита рекомендуется повторение циклов процесса путем увлажнения полученного первоначально и измельченного продукта. Содержание усвояемой Р2О5 в продукте достигает 98% по отношению к общей Р2О5. В зависимости от соотношения между фосфоритом и монокальцийфосфатом (или кислотой) усвояемая Р205 может частично находиться в водорастворимой форме за счет неполного использования монокальцийфосфата (или кислоты). Концентрация усвояемой Р205 в продукте, полученном с применением фосфорной кислоты, близка к таковой в двойном суперфосфате. Расход фосфорной кислоты на разложение фосфорита (на единицу усвояемой Р205 в продукте) составляет примерно 3/4 от обычного при производстве двойного суперфосфата.
Предложено 67,68 получать преципитат осаждением его из пульпы, образующейся при сернокислотном разложении фосфатов. Преципитат отделяется от гипса методом флотации. В лабораторных условиях этим способом получен продукт с содержанием 30% усвояемой Р2О5 при степени извлечения до 80%.
По другому, циклическому способу 32>69 преципитат получается из продукта неполного разложения фосфата серной кислотой, из которого выщелачивается водой водорастворимая Р2О5. Образующийся раствор (13—15% Р205) перерабатывается в преципитат. Нерастворимый остаток после выщелачивания разделяется на ангидрит и неразложенный апатит методом мокрой классификации. Апатит возвращается на повторное разложение, а ангидрит используется в производстве серной кислоты и цемента.