Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПОЛУЧЕНИЯ МИРАБИЛИТА ИЗ ПРИРОДНЫХ РАССОЛОВ
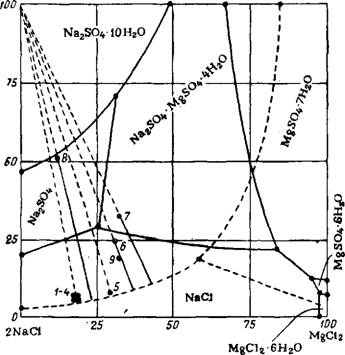
Мирабилит можно получить из рассолов почти всех морей и озер и тем с большим удельным выходом, чем больше коэффициент метаморфизации MgS04: MgCb. В табл. 12 приведено содержание солей в воде океана, некоторых морей и соляных водоемов. Составы солей отдельных водоемов нанесены на диаграмму растворимости в системе NaCl—MgS04—Н20 (рис. 28)82>83. При испарении в испарительных бассейнах воды океана 1, Средизем-
ТАБЛИЦА 12
Состав воды океана, некоторых морей н соляных водоемов
|
Химический состав, вес. И |
^gso |
|||||||
|
Са(НС03)2 |
CaS04 |
MgS04 |
MgCl2 |
MgBr2 |
KCI |
NaCl |
Сумма солей |
MgCl; |
|
0,017 |
0,12 |
0,22 |
0,33 |
0,007 |
0,07 |
2,80 |
3,66 |
0,67 |
|
0,016 0,027 |
0,13 0,068 |
0,24 0,12 |
0,31 0,16 |
0,003 |
0,05 0,04 |
2,84 1,45 |
3,63 1,87 |
0,77 0,75 |
|
0,020 0,028 |
0,38 0,31 |
0,86 0,94 |
1,14 1,93 |
0,022 0,029 |
0,27 0,36 |
9,61 7,76 |
12,30 11,36 |
0,75 0,49 |
|
0,011 0,02 |
0,09 0,154 |
0,31 0,26 0,036 |
0,061 0,007 0,142* |
0,0008 |
0,013 0,018 |
0,81 0,56 0,143 |
1,29 1,03 0,321 |
5,1 37,2 |
|
0,08 |
0,09 |
5,55 |
3,05 |
- |
- |
18,74 |
27,51 |
1,82 |
|
ТАБЛИЦА 13 |
|
Океан.... Средиземное Море.... Черное море. Сиваш (южная часть) . . . Сакское озеро Каспийское Море.... Аральское море Оз. Балхаш. . Залив Кара - Богаз (осень . 1938 г.) . . . * Na2S04. |
Выход мирабилита и расход воды и рассолов нз разных водоемов31
|
Каспийское |
Аральское |
Оа. |
Черное |
Овваш |
|
|
Море |
Море |
Балхаш |
Море |
||
|
Расход воды (в м3) для по |
|||||
|
Лучения 1 м3 раствора, на |
|||||
|
Сыщенного NaCl: |
|||||
|
Без кристаллизации NaCl |
29 |
45 |
126 |
— |
|
|
. с кристаллизацией NaCl |
— |
— |
— |
66 |
8,6 |
|
Расход воды (в мъ) для по |
|||||
|
Лучения 1 т мирабилита. . |
182 |
196 |
256 |
538 |
69,5 |
|
Расход насыщенного рассола |
|||||
|
(в м3) для получения 1 т |
8,2 |
||||
|
Мирабилита ................................. |
6,28 |
4,85 |
2,05 |
8,2 |
|
|
Выход (в кг): |
|||||
|
Мирабилита из 1 м3 насы |
|||||
|
Щенного рассола.... |
160* |
230* |
490* |
122,4 ** |
122,4 ** |
|
NaCl прн получении 1 м3 |
710 |
710 |
|||
|
Насыщенного рассола. |
0 |
0 |
9 |
||
|
NaCl на 1 т мирабилита |
0 |
0 |
0 |
6,8 |
5,8 |
|
* При охлаждении рассола до 0°. ♦♦ При охлаждении рассола до —10*. |
Ного 2, Черного 3 и Каспийского 6 морей, Сиваша 4, Сакского озера 5 и Карабогазского залива 9 образуются растворы, насыщенные поваренной солью, которая при дальнейшем испарении и будет кристаллизоваться в качестве первой твердой фазы. При концентрировании воды Аральского моря 7 получается раствор, насыщенный астраханитом, а воды оз. Балхаш 8— тенардитом. Таким об-
|
Na2SQ4 MgSO*
Рис. 28. Диаграмма растворимости в системе NaCl—MgS04—Н20: при 25 (сплошные линии) и 0° (пунктирные линии), |
Разом, из всех перечисленных здесь вод в летний период можно получить сульфат натрия только из воды оз. Балхаш. Выход тенардита из 1 м3 балхашского рассола составляет 110—120 кг, а степень использования SO^- всего 50—55%; при зимней же садке мирабилита степень использования SOf достигает 90—95%.
При охлаждении упомянутых насыщенных растворов до 0° все они становятся насыщенными мирабилитом, который и выделяется в твердую фазу. Выход сульфата натрия и расход начального и насыщенного рассола на 1 т мирабилита зависят от исходной концентрации солей и SC>4~ (табл. 13).
При охлаждении 1 м3 насыщенного NaCi рассола Сиваша до —5° выделяется всего 32 кг мирабилита, что в 5 раз меньше выхода мирабилита при охлаждении до 0° насыщенного рассола Каспийского моря. Малый выход мирабилита при охлаждении концентрированной воды Сиваша и Черного моря объясняется низкой
|
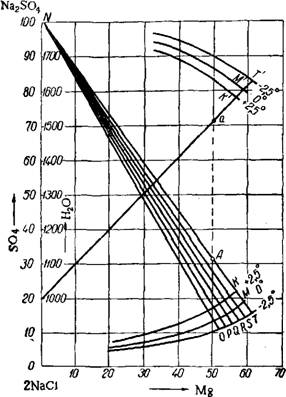
Рис. 29. Диаграмма растворимости в системе NaCl—MgS04—Н20 при +2,5, 0 и —2,5°. |
Концентрацией S04~B этой воде. Для увеличения выхода мирабилита из черноморских рассолов необходимо предварительно выделить из них часть поваренной соли путем более глубокого испарения, а затем охлаждать их до более низкой температуры, например до —10°.
Выход мирабилита при охлаждении сульфатной рапы определяется относительным и абсолютным содержанием в ней солей. Оптимальное содержание суммы солей, соответствующее максимальному выходу мирабилита, не загрязненного галитом, можег быть определено графически по диаграмме растворимости в системе NaCl—MgS04—Н20. На рис. 29 представлена такая диаграмма, составленная для карабогазской рапы83. Концентрации S04 и Мg выражены в индексах. На диаграмме нанесены изотермы растворимости для +2,5, 0 и —2,5° и содержание воды в насыщенных растворах в молях на 100 моль солей (в верхней части диаграммы). Шесть лучей кристаллизации мирабилита, проведенных из точки N до пересечения с линиями растворимости, соответствуют следующим значениям хлормагниевого коэффициента, характеризующего весовое отношение ионов хлора и магния:
Луч.................. NT NS NR NQ NP NO
I§2+-....................... 4>° 4-2 4-4 4-6 4>3 5-°
В качестве примера определим оптимальную концентрацию
Рапы, характеризующейся коэффициентами: = 4,0 и =*
= 2,0. Положение точки А состава рапы на диаграмме определяется индексами: SO4 — 30,8, Mg — 50,0. Проводя из точки А вертикальную линию до пересечения в точке а с водной проекцией луча кристаллизации,, находим оптимальное содержание воды в рапе данного солевого состава, равное 1515 М/100 М солей. Практически необходим небольшой избыток воды для предотвращения загрязнения мирабилита галитом, так что содержание воды в рапе перед ее охлаждением можно принять равным 1525 М/100 М солей. Пересчитывая индексы на весовые количества, находим вес 100 М рапы и процентное содержание в ней солей:
|
SO*- . |
. 30,8 |
96 = |
2 957 |
Г |
Или |
7,6% |
|
Cr. . |
. 69,2 |
71 = |
4913 |
» |
» |
12,7% |
|
. 50 |
24,3 = |
1 215 |
» |
» |
3,1% |
|
|
Na+ , |
. 50 |
46 ■= |
2 300 |
» |
5,9% |
|
|
H20 . . |
. 1525 |
18 = |
27 450 |
» |
» |
70,7% |
|
38 835 |
Г |
100,0% |
Следовательно, оптимальное и предельно допустимое содержание суммы солей в данной рапе перед ее охлаждением для садки мирабилита равно 29,3% •
Выход мирабилита (я к$) иэ 1 м3 можно рассчитать по отношению длин отрезков AM : NM, пользуясь формулой
AM lQOa • 322d • 10 * NM ' С-96
Где 100 — индекс мирабилита по SO4; D — плотность охлаждаемой рапы; 322 и 96 — мол. веса мирабилита и SO4; а — содержание SO4" в охлаждаемой рапе, %; с — индекс по S04 охлаждаемвй рапы. Для приведенного выше примера AM : NM = 0,142, с = 30,8,
а = 7,6, D — 1,25; после подстановки этих величин в формулу получаем х = 150 кг/м3.
На рис. 30 показан выход мирабилита из рапы разного состава при оптимальном содержании солей в зависимости от величины коэффициента метаморфизации рапы. Изменение хлормагниевого коэффи
Циента С1~: Mg2+ в пределах от 4 до 5 мало влияет на величину выхода и показано на диаграмме заштрихованной площадью в пределах «от» и «до»83.
При использовании рассолов с большим содержанием MgS04 их разбавляют до охлаждения более | слабыми растворами или раство - | ром поваренной соли84. ^
Рапа, остающаяся после кри - £ сталлизации мирабилита, содержит большое количество MgCI2 и другие ценные компоненты и может служить объектом дальнейшей переработки 47>85-88.
Сгущенная хлормагнневая рапа Может служить материалом для получения хлористого магния (а из него окиси магния и соляной кислоты), брома, бора и других продуктов. Рассмотрим в качестве примера комплексную схему переработки Кучукской рапы. Эта рапа после зимней садки мирабилита содержит, например (в %):
TOC o "1-3" h z NaCl................................... 16,52
MgCl2...................... 4,78
MgSO«..................................... 0,69
|
Ca(HC03)2 KC1 . . . . KBr. . . . B203 . . . |
|
0,066 0,029 0,045 0,013 |
CaS04 . . . . i. . . 0,08
При вакуум-выпарке до 23% MgCl2 из рапы кристаллизуется чистая поваренная соль, без примеси MgS04 и CaS04. Полученный рассол содержит ~ 1,9 кг/м3 брома, после отгонки которого из него можно осадить хлористым кальцием полуводный гидравлический гипс. При дальнейшей выпарке обессульфаченной рапы до 32% MgCl2 выделяется дополнительное количество NaCl. После репульпации кристаллов NaCi, полученных в 1-й и 2-й стадиях выпарки, с почти насыщенной NaCl рапой, поступающей на выпарку из рапохранилища, концентрация MgCl2 в межкристальной жидкости снижается до 8—9%, а после центрифугирования в поваренной соли остается меньше 0,6% MgCI:2. При промывке ее'на
Центрифуге водой получается соль высшего сорта, почти соответствующая соли сорта экстра; она содержит всего по ~0,04% M. g и Са. После отделения поваренной соли концентрированный раствор MgCl2 окончательно выпаривается до шестиводного, а затем до двухводного хлористого магния (см. гл. IX). Последняя стадия выпарки сопровождается частичным гидролизом MgCl2, и выделяющийся хлористый водород может быть поглощен известковым молоком для получения хлористого кальция, частично используемого для обессульфачивания рапы.
Разработаны и другие схемы комплексного использования маточных рассолов морского типа после садки мирабилита 59. В частности, путем их выпаривания при температуре кипения (126°) и Последующего охлаждения до 70° и разделения образующихся твердых солей из них можно выделить шенит K2SO4 • M. gS04 • 6Н20, используемый в качестве удобрения (см. гл. V)87.
При испарении в лабораторных условиях маточных растворов, остающихся после кристаллизации мирабилита из охлажденных астраханитовых растворов, при 20—25° выделяется эпсомит не только в стабильном поле его кристаллизации, но и в метаста - бильной области, захватывающей часть поля астраханита. Например, из 1 т астраханитового сырья оз. Куули можно получить 1 I Мирабилита и 0,3 т эпсомита 31.
Переработкой твердых отложений астраханита приаральских озер путем водной обработки, охлаждения полученного смешанного раствора с выделением мирабилита и с последующим его плавлением, и выпарки маточных растворов с кристаллизацией NaCl, можно получить из Гг астраханитовой породы 0,45 т безводного сульфата натрия, 0,17 т поваренной соли и 0,18 г MgCl2 • 6Н20 ».