Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ЦИАНАМИД КАЛЬЦИЯ
Получение цианамида кальция основано на взаимодействии карбида кальция с азотом по обратимой реакции: СаС2 + N2 CaCN2 + С + 70 ккал
Реакция азотирования карбида кальция начинается уже при 700—800° и протекает с большой скоростью при 1000—1100° 42>43.
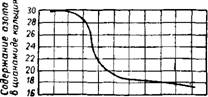
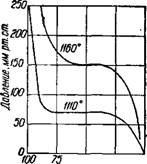
На рис. 453 представлена изобара реакции образования цианамида кальция при атмосферном давлении. С повышением температуры уменьшается содержание азота в твердой фазе (цианамиде кальция) и возрастает равновесное давление азота в системе CaCN2—N2, которое зависит также от степени азотирования карбида кальция (рис. 454).
|
50 25 О Степень азотиро0ания,% |
|
Рис. 454. Давление азота в системе CaCN2—N3 в зависимости от степени азотирования карбида кальция. |
Цианамид кальция (с максимальным содержанием азота, равным 29%) вполне стабилен вплоть до 1120—1130°. В диапазоне 1130—1200° происходит уменьшение содержания азота в твердой фазе. Температура 1200° соответ-
|
|
|
1100 |
|
1500 |
|
1200 1300 1400 Температура, °С |
|
Рис. 453. Равновесие в системе CaCN2—N2 при атмосферном давлении. |
Ствует стабильному существованию цианамида кальция с содержанием 21% азота. Обратимость реакции имеет место вплоть до 1400° при уменьшающемся содержании азота в твердой фазе. Выше 1400° цианамид кальция диссоциирует необратимо по реакции:
C + CaCN2 = Ca + 2C + N2
Высокопроцентный цианамид кальция можно получить при температуре не выше 1100°, когда разложение цианамида кальция еще незначительно. Степень азотирования или содержание азота в полученном продукте зависит также от чистоты и качества применяемых азота и карбида кальция. Последний должен иметь литраж 290—300 л/кг. (Под литражом карбида кальция понимают количество литров ацетилена при 20° и 760 мм рт. ст., выделяемого 1 кг карбида кальция при обработке его водой). Для азотирования применяют азот, содержащий 99,8% азота и лишь 0,2% примесей (кислорода, аргона и др.). Скорость реакции возрастает в присутствии 10% СаС12 или 2—3% CaF2. В промышленных условиях к карбиду кальция добавляют 2—3% плавикового шпата и процесс ведут при 800—1150°.
Во избежание снижения выхода цианамида содержание в карбиде кальция примесей SiC>2, глинозема, окиси магния, силикатов и других примесей должно быть минимальным 44.
Получение цианамида кальция в электрических печах
Процесс азотирования карбида кальция — экзотермический при 800—1000° протекает автотермично. Предварительный разогрев шихты до температуры начала реакции осуществляют преимущественно с помощью электрического тока. Применяют также газовый обогрев.
|
Азот
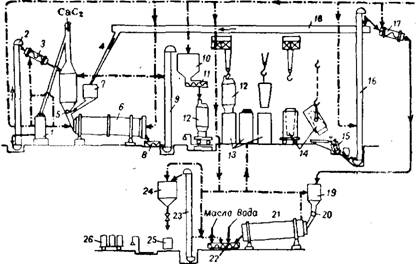
Рис. 455. Схема производства цианамида кальции: 1, 15 — дробилки; 2, 9, 16, 23 - элеваторы; 3, 8, 11, 18, 22-шнеки; 4, 7, 10, 19, 24— бункеры; 5, 20— питатели; 6, 21— трубчатые мельницы; 12 — загрузочный цилиндр; 13 — циаиа- мидиые печи; 14 — охладительные стаканы; 17 — шнековый транспортер; 25— барабан для укупорки; 26 — вагонетка. |
Получение цианамида кальция осуществляют большей частью в печах периодического действия вследствие необходимости длительной обработки материала. Из различных конструкций печей непрерывного действия эксплуатируются преимущественно канальные печи при использовании шихты с добавкой хлористого кальция. Возможно использование и вращающихся трубчатых печей 43.
Основным типом цианамидной печи периодического действия, является ретортная печь 43'45, получившая свое название от способа загрузки в нее шихты с помощью бумажной или картонной «ре
торты». В настоящее время все больше используют печи периодического действия без реторт, и карбидную шихту загружают непосредственно в печь.
На рис. 455 показана схема производства цианамида кальция 46. Карбид кальция с размерами кусков до 100 мм вначале дробят, затем измельчают в трубчатой мельнице до тонкости, при которой 98,5% материала проходит через сито с 900 отв/см2. В Трубчатую мельницу подают также плавиковый шпат и около 15% цианамида кальция. Введение в шихту возвратного цианамида кальция позволяет предотвратить или уменьшить спекание шихты и Снизить температуру процесса, так как CaCN2 является катализатором реакции азотирования. Измельченную шихту подают через бункер к загрузочным цилиндрам, служащим для непосредственной загрузки шихты в цианамидные печи и расположенным в печном отделении. В цилиндр загружают автоматически 1200—1300 кг шихты и устанавливают, его при помощи мостового крана на съемную воронку цианамидной печи. Загрузку шихты в печь производят при открывании затвора загрузочного цилиндра с помощью воронки, снабженной вибратором, служащим для уплотнения шихты в печи.
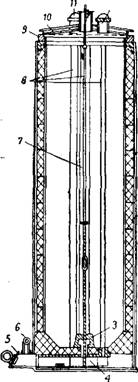
Цианамидная печь с непосредственной загрузкой шихты представляет собой стальной цилиндр, футерованный изнутри шамотным кирпичом (рис. 456), высотой около 3 м, диаметром вверху 0,8 м и внизу 0,76 м. Сужение шахты печи книзу облегчает выгрузку циан - амидного блока. Печь закрывается крышкой с песочным затвором. В нижней части имеется зольная коробка с Трубопроводом для подачи азота. Распределение азота в шихте производится
|
Рис. 456. Цианамидная печь: / — цилиндр (кожух); 2— футеровка (шамотный кирпич); 3 — чугунный конус; 4 — зольная коробка с контактной плитой; 5 —люк; 6 — трубопровод дл» азота; 7 —электрод; 5 —каналы; 9 — песочный затвор; 10—Крышка; 11 — штуцер. |
По трем вертикальным каналам, образуемым при помощи трех стальных труб, вставляемых в печь перед загрузкой шихты и Удаляемых после загрузки. Таким же образом устроен центральный канал, в который вводят нагревательный электрод; с его помощью осуществляют начальный подогрев карбида. На дно печи
укладывают чугунный конус, который сцепляется с металлической штангой при извлечении цианамидного блока из печи с помощью мостового крана. Выгруженный цианамид помещают в стальные стаканы, где он охлаждается до 40—50° в течение 24—40 ч. Затем его измельчают и основную массу измельченного продукта обрабатывают водой с целью разложения непрореагировавшего карбида кальция и минеральным маслом для уменьшения пыления. При переработке цианамида кальция в цианплав и другие химические продукты его подвергают более грубому помолу (стр. 1524). В этом случае не производят обработки его водой и маслом.
Процесс азотирования карбида проводят следующим образом. Загрузку шихты в печь производят в течение 10—12 мин. Затем закрывают печь, продувают ее азотом в течение 8—10 мин для удаления воздуха и включают нагрев электрода. Нагревание шихты до температуры интенсивного взаимодействия карбида с азотом продолжается в течение 2—3 ч при непрерывной подаче азота под избыточным давлением 5—10 мм вод. ст. После этого прекращают нагрев, электрод удаляют из печи, закрывают электродный канал и увеличивают давление подаваемого азота до 20 мм вод. ст. (сверх атмосферного). Спустя 4 ч начинают удалять из печи выделяющиеся газы (ацетилен и др.) через отверстие в крышке, закрывающей электродный канал. Подачу азота В печь продолжают, пока температура в печи не снизится до 600—700°.
После этого подачу азота прекращают и оставляют цианамид В печи на 1—2 ч для остывания, и затем его выгружают. Весь процесс с учетом времени загрузки и выгрузки длится 40—50 ч. Производительность описанной печи за 1 цикл составляет около 1,5 т цианамида кальция. На производство 1 т цианамида кальция (в пересчете на продукт, содержащий 18% „азота) расходуют: 0,785 т карбида кальция, 630 мъ азота, 0,020 т плавикового шпата (85% CaF2) и 90 квт-ч электроэнергии.
Производство цианамида кальция является взрывоопасным вследствие возможности выделения ацетилена при соприкосновении карбида кальция с влагой и образования взрывчатой смеси из ацетилена и воздуха. Поэтому все аппараты должны быть заполнены азотом (вместо воздуха) и хорошо герметизированы, а производственные помещения должны вентилироваться для предотвращения проникания вредной цианамидной пыли. В присутствии ничтожных количеств спирта в организме (даже от лекарств, приготовленных на спирте) вдыхание цианамидной пыли вызывает приступы удушья. Рабочий персонал, обслуживающий производство цианамида кальция, должен быть снабжен защитными средствами — респиратором, очками и сухой спецодеждой. Перед началом работы надо смазать лицо и руки тонким слоем вазелина.
Получение гранулированного цианамида кальция
Помимо порошкообразного цианамида кальция выпускают гранулированный в виде зерен размером 2—5 мм, который не пылит и более удобен при пользовании. Перед грануляцией цианамид кальция увлажняют с целью гашения содержащейся в цианамиде окиси кальция и разложения остатков карбида кальция. Применяют разные способы гранулирования цианамида кальция 45>47. Наиболее простой — это грануляция в мешалках непрерывного действия. Более совершенный гранулятор представляет собой два вальца, из которых один сплошной, другой —■ полый с дырчатой поверхностью. Массу вводят между цилиндрами — вальцами гра - нулятора. При вращении полого цилиндра цианамид кальция продавливается через отверстия внутрь цилиндра и превращается при этом в палочки, которые удаляются из внутренней части цилиндра при его вращении, и ленточным транспортером передаются в сушильное отделение.
При увлажнении цианамида кальция происходит частичная потеря азота вследствие взаимодействия CaCN2 с водой: CaCN2 + ЗН20 = 2NH3 + СаСО,
Поэтому более целесообразным, по-видимому, является связывание свободной окиси кальция не водой, а двуокисью углерода 43, а также использование для гидратации раствора Са (N03)2 48,49.
Для придания гранулам цианамида кальция большей механической прочности предложено 50 их дополнительно увлажнять и высушивать нагретым воздухом при 80—90°. При этом 10—15% воды химически связывается с цианамидом кальция, а остальное количество воды удаляется при сушке.
Другие методы получения цианамида кальция
Азотирование карбида кальция непрерывным путем возможно в печах различной конструкции43: канальных (или туннельных) печах с газовым или электрическим обогревом, вращающихся трубчатых печах, в шахтных печах, в вертикальной печи, выполненной в виде усеченного конуса и др.51. Из них некоторое применение нашли канальные и вращающиеся печи.
Основными причинами, затрудняющими проведение процесса непрерывным путем, являются большая длительность реакции азотирования, трудность регулирования температуры и спекание образующегося продукта.
Для ускорения процесса предлагают52 применять порошкообразный карбид.
Описано53 производство цианамида кальция во вращающихся печах производительностью ~20—22 тыс. т в год (55—60 г в сутки) цианамида кальция с применением карбида кальция размером 0,075—2 мм с добавкой 1—2% СаС12. Печь общей длиной 12 м н наружным диаметром 3 м установлена под наклоном 3° и вращается со скоростью 5 об/мин. Азотирование начинается при 750°. Отвод тепла реакции производится при помощи ребер, приваренных на наружной поверхности средней части барабана, где температура поднимается до 1000°. Пуск печи осуществляется сжиганием антрацита и после достижения необходимой температуры в дальнейшем реакция азотирования протекает автотермически.
Получение порошкообразного цианамида кальция (вместо спекшегося продукта) возможно54'55 при вдувании тонкодисперсного карбида (с размерами частии 0,09—0,058 мм) сжатым углеводородным газом в башню — печь, куда одновременно поступает азот, и для поддержания ~800° кислород в количестве, необходимом только для сжигания углеводородов до окиси углерода и водорода (но не до двуокиси углерода и Н20). Азотирование карбида кальция в печи со взвешенным слоем 56 возможно явится лучшей основой для создания совершенного непрерывного способа получения цианамида кальция.
Представляют также интерес предложения по ускорению азотирования в периодических печах. Так, установка в цилиндрических печах трех электродов (вместо одного, центрального) позволяет ■сократить время азотирования57 на ~20%. При загрузке центральной части печи высоколитражным карбидом (260—270 л/кг), а периферийных частей — мелочью достигается лучшее использование тепла и более быстрое азотирование мелкого карбида за счет избытка тепла, получаемого в начале процесса 63.
Некоторые преимущества в общем технологическом процессе получения карбида и цианамида кальция может дать введение добавки CaF2 в шихту, используемую для производства карбида59. С другой стороны, имеются указания 60 на большую эффективность в процессе получения цианамида кальция добавок NaF, A1F3 или Na3AlF6 по сравнению с CaF2.
Рекомендуют 61,62 производить цианамид кальция, содержащий до 2,5% азотнокислого калышя, обработкой его распыленной 40—60%-ной азотной кислотой.
Представляют интерес бескарбидные способы получения цианамида кальция (с содержанием до 35% азота) взаимодействием лммиака с карбонатом или окисью кальция 63-66 при 700—800 я присутствии в качестве катализатора CaF2 по реакции:
СаСОз + 2NH3 = CaCN2 + ЗНГО
Равномерная температура (~750°) в реакционном слое может ■быть достигнута 64 применением гранулированного карбоната кальция с постоянной величиной гранул.
При использовании окиси кальция реакция протекает в присутствии ^глеродсодержащих соединений (СОа, СН4, СО и др.): СаО + С02 + 2NH3 = CaCN2 + 3H20 СаО + СН4 + 2NH3 = CaCN2 + Н20 + 4Н2 СаО + 2СО + 2NH3 = CaCN2 + С02 + Н20 + 2Н2
Продукт, образующийся по последней реакции, содержит до 31% азота67'68 (вместо 18—20%) в продукте, полученном из карбида кальция). Взаимодействием известняка с аммиаком в присутствии метана или пропан-бутановой смеси при 1000—1150° были получены в лабораторных условиях продукты, содержащие до 33,5% азота69. Примеси соединений Fe203 и Р205, содержащиеся в известняке, снижают концентрацию азота в продукте вследствие взаимодействия их с углеводородами. Примесь водяных паров в газовой смеси уменьшает использование аммиака70.
Процесс можно осуществить в аппаратах со взвешенным слоем 7 во вращающихся барабанах и в печах других конструкций с применением известняка или извести с мелкими или крупными размерами зерен или кусков.
Отходящие из реактора газы, содержащие HCN, NH3 и С02, можно регенерировать 72 и вновь использовать.
Чистый цианамид кальция, не содержащий графита и состоящий на 97% из CaCN2, можно получить из карбамида и извести73. Вначале получают при 300° промежуточный продукт — смесь ци - анурата, цианата и окиси или карбоната кальция, который затем после охлаждения и измельчения прокаливают при 700° в течение 14 ч. Предложено 74 получать белый цианамид кальция из Са(ОН)2, СО и N2 в печи со взвешенным слоем, состоящей из нескольких камер, разделенных подами и каналами. В нижнюю камеру подводятся реакционные газы, и из нее отводится готовый продукт. В верхнюю камеру подается гидроокись кальция, и из нее отводятся отходящие газы. Вместо Са(ОН)2 можно также использовать СаО75, предварительно обработанную при помощи НС1 в псевдо - ожиженном слое при 500—950°.
В связи с развитием производства синильной кислоты из метана и аммиака, перспективным является получение цианамида кальция взаимодействием карбоната кальция с цианистым водородом при 850—900°. Выход цианамида кальция при этом достигает 98%, и образующийся продукт не содержит полимеров цианистого водорода 76.
ПРОИЗВОДСТВО ЦИАНИДОВ НАТРИЯ И КАЛИЯ
Существует много способов получения цианистых солей натрия, калия и других металлов:
1) нейтрализация синильной кислоты или поглощение цианистого водорода растворами щелочей или карбонатов;
взаимодействие цианамида кальция с углем и карбонатом натрия или хлоридом натрия (получение цианплава);
фиксация азота смесью соды с углем;
восстановление цианатов, полученных из NH3 и карбонатов;
сплавление амида натрия с углем;
сухая перегонка барды;
получение цианидов из коксового газа.
До недавнего времени основными методами получения цианистых солей были переработка цианамида кальция в цианплав и сплавление амида натрия с углем 11. Полученные таким образом цианиды использовались для производства синильной кислоты78'79. В настоящее время освоены в промышленности экономичные методы прямого синтеза синильной кислоты из природного газа и аммиака (стр. 1532). По мере расширения производства синильной кислоты, она может быть использована и для получения цианистых солей.
Получение цианистых солей из синильной кислоты
Нейтрализация синильной кислоты растворами щелочей или карбонатов является наиболее простым способом, позволяющим получить чистые цианистые соли, например:
HCN + NaOH = NaCN + Н20
Расход реагентов можно регулировать потенциометрическим методом 80.
Концентрированные растворы чистых солей высушивают в вакуум-вальцовых сушилках или другими способами, или из них кристаллизуют 81 цианид, а маточный раствор после отделения центрифугированием от кристаллов возвращают в процесс. При предварительной подсушке кристаллов на центрифуге инертным газом, подогретым до 30—40°, получается соль, содержащая около 6% ■влаги82. Окончательную сушку продукта можно производить при помощи газов, имеющих температуру ~90°. В высушенной соли остаются примеси щелочи.
Для понижения содержания щелочи в сухом цианиде натрия предложено 83 пропускать над ним в течение 5—7 мин струю сухого воздуха при 110—120°, содержащего 0,5—1% С02.
Представляет интерес получение цианида калия в результате обменной реакции в расплаве84:
KCI + NaCN KCN + NaCl
Получающийся этим методом цианид калия практически не содержит других анионов.
Получение цианплава из цианамида кальция
При высоких температурах технический цианамид кальция ь присутствии угля превращается в цианид кальция: CaCN2+C Ca(CN)2 — 24,6 ккал
На этом основано промышленное получение цианидов сплавлением цианамида кальция с углем и с поваренной солью или содой: CaCN2 + С + 2NaCl = 2NaCN + СаС12 CaCNj + С + Na2C03 = 2NaCN + СаО + С02
Реакция с содой идет при 800—850°. Реакция с поваренной солью протекает при значительно более высокой температуре (1400—1500°). Несмотря на это, в промышленности чаще применяется поваренная соль, более дешевая, чем сода. Кроме того, реакция с поваренной солью протекает намного быстрее, чем с содой.
Сплавление производят в электрических печах.
Образовавшийся цианилав выпускают из печи через летку при ~ 1500°. Так как плав нестоек и при медленном остывании в пределах от 800 до 400° распадается обратно на цианамид и уголь, то его необходимо охладить быстро. Охлаждение производят на поверхности вращающегося барабана, внутрь которого подают проточную воду. Застывший плав снимается с барабана ножом и поступает на упаковку в стальные барабаны, которые быстро за - вальцовывают во избежание потери продуктом синильной кислоты под действием двуокиси углерода и влаги воздуха. Полученный таким способом продукт называется цианплавом или черным цианидом (черный цвет обусловлен присутствием угля). Цианплав содержит цианиды в виде NaCN и Ca(CN)2 и примеси NaCl, СаС12, С, СаС2 и др. На производство 1 т цианплава (45% NaCN) расходуют 0,72 т цианамида кальция, 0,3 т поваренной соли и 960— 1000 квт-ч электроэнергии.
Большую часть вырабатываемого цианплава используют непосредственно без дальнейшей его переработки на чистые цианистые соли, например для окуривания растений и для дезинсекции. Цианплав смачивают водой, в результате чего он разлагается на воздухе с выделением газообразной синильной кислоты: Ca(CN)2 + С02 + Н20 = СаСОз + 2HCN
Выделение цианистого водорода ускоряется при измельчении цианплава до величины частиц менее 1 мм и подогреве смеси его с водой 85.
Фиксация азота смесью соды с углем
При пропускании азота через нагретую смесь натрия и угля образуется цианид натрия:
2Na + 2С + N2 «= 2NaCN + 46 ккал
Эта реакция значительно ускоряется в присутствии металлов (Fe, Ni, Мп). Ввиду того, что натрий является весьма дорогим материалом, получение цианида натрия осуществляют фиксацией азота смесью соды и угля при 950—1000° под давлением 15 ат В присутствии катализаторов8б. При этом, по-видимому, сода восстанавливается до натрия
Na2C03 + 2С = 2Na + ЗСО - 186 ккал
А натрий реагирует с углем и азотом. В общем процесс идет по Суммарной реакции:
Na2C03 + 4С + N2 = 2NaCN + ЗСО - 140 ккал
Вместо соды могут применяться другие карбонаты (К2СО3, ВаСОз и пр.), причем получаются соответствующие цианиды. Предложено 87 осуществлять процесс в присутствии паров воды с целью получения непосредственно цианистого водорода.
Восстановление цианатов, полученных из аммиака и карбонатов
По этому способу за рубежом получали значительные количества цианистых солей. Он заключается в обработке газообразным аммиаком раскаленной смеси щелочного карбоната и угля. При этом вначале образуется цианат:
К2С03 + NH3 = KCNO + КОН + Н20
Затем цианат восстанавливается углем в цианид: KCNO + С = KCN + СО
Из полученного плава цианид выщелачивают водой, затем выделяют выпаркой и кристаллизацией.
Возможно88 получение цианида из ВаСОз и NH4C1 в присутствии металлического калия при 600—700°. Реакция заканчивается в течение 1 ч. По-видимому, процесс протекает по следующей схеме:
2ВаС03 + 2NH4C1 = Ba(CNO)2 + ВаС12 + 4Н20 Ba(CNO)2 + 2К - 2KCN + ВаО + У202
Обработкой плава кислотой отгоняют HCN в раствор щелочи. Выход HCN составляет 93—95%• При использовании металлического натрия вместо калия выход HCN снижается до 50%.
Сплавление амида натрия с углем
При обработке расплавленного натрия сухим газообразным аммиаком при 350—500° в периодически или непрерывно действующих чугунных ретортах образуется амид натрия: 2Na + 2NH3 = 2NaNH2 + Н2
Расплавленный амид натрия обрабатывают в стальных котлах древесным углем при 600—800°. Образующийся вначале цианамид натрия
2NaNH3 + С = Na2CN2 + 2Н2
Превращается затем в цианид
Na2CN2 + С = 2NaCN
Суммарной реакцией получения цианида натрия этим методом является:
2Na + 2С + 2NH3 = 2NaCN + ЗН2
На некоторых заводах обе стадии процесса — получение амида натрия и переработку его в цианид — осуществляют в одном аппарате — в котле, заполненном углем, в который подают аммиак и натрий. Этот способ дает возможность получать цианистый натрий с большим выходом — 98—99%. Полученный расплавленный цианистый натрий отделяют от угля фильтрованием. Продукт содержит до 97% NaCN. По другому варианту цианистый натрий выщелачивают из остывшего плава водой, растворы очищают и перерабатывают на твердый продукт.
Отходы свеклосахарных производств — черная патока или меласса и винокуренных заводов — барда — содержат до 2% азота. При сухой перегонке этих отходов в закрытых ретортах остается бардяной кокс и выделяются газы, содержащие С02, СО, Н2, СН4, С2Н2, NH3, N2 и метиламины. Эти газы перегревают до 1000—1100°, причем метиламины разлагаются с образованием цианистого водорода:
3CH3NH2 = NH4CN + HCN + СН4 + ЗН2 (CH3)3N = HCN + 2СН4
Возможно, что происходит и взаимодействие аммиака с углем ' NH3 + C=HCN + H2
А также и ряд других реакций, ведущих к образованию HCN.
В результате этих реакций газ, выходящий из перегревателя, содержит до 7% HCN и до 7% NH3. Для поглощения аммиака охлажденный газ промывают серной кислотой, после чего цианистый водород поглощают растворами щелочей.
При сухой перегонке барды из общего количества содержащегося в ней азота лишь 25% превращается в цианистые соединения, примерно столько же — в аммиак; половина азота теряется в виде элементарного азота. : .
Предложены различные способы выделения HCN из газовой смеси, при которых не расходуется серная кислота;, например,
24 м. е. позин промывкой водным раствором NH4OH при 50—60°89'90 двуокись углерода можно связать в (NH4)2C03 8Э. В присутствии СОг растворимость HCN мала и основная его масса остается в газе90, из которого он поглощается щелочным раствором.
Из водных растворов HCN, содержащих также другую кислоту и аммиачную ее соль, можно отогнать под вакуумом практически весь цианистый водород и небольшое количество воды 91.
Получение цианидов из коксового газа
Коксовый газ содержит небольшие количества цианистых соединений, в которые переходит всего 1—2% азота, содержащегося в коксуемом угле. Образование цианистого водорода происходит из содержащегося в газе аммиака главным образом по следующим реакциям:
NH3 + C0 = HCN + H20 2NH3 + С2Н2 = 2HCN + ЗН2
Некоторые количества HCN образуются и по другим реакциям, в результате взаимодействия аммиака с углеродом, метаном, этиленом, а также в результате разложения имеющегося в газе три - метиламина на HCN и СН4. При охлаждении газа образуется легколетучий цианистый аммоний, который, взаимодействуя с находящимся в газе сероводородом, дает роданистый аммоний: 2NH4CN + 2H2S + 02 = 2NH4NCS + 2Н20
При водной промывке коксового газа в раствор переходят, наряду с HCN, также NH3, H2S и С02. Дистилляцией полученного раствора можно выделить в виде дистиллята, отводимого из верхней части колонны, до 98% от всего количества HCN в смеси с небольшим количеством аммиака92. Сероводород и двуокись углерода выходят из колонны в газообразном виде. В кубе остается до 99,5% NH3 в виде разбавленного раствора.
Представляет интерес выделение небольших количеств синильной кислоты из сточных вод производства сульфата аммония из аммиака коксового газа. Они образуются при промывке, ведущейся с целью обезвреживания газов, отходящих из сатураторов поглощения аммиака серной кислотой и содержащих 100—3000 мг/л синильной кислоты и сероводорода и незначительные количества аммиака. Предложена 93 двухступенчатая очистка сточных вод, заключающаяся в раздельной отдувке из них воздухом сероводорода и синильной кислоты. Скорости диффузии HCN и H2S из жидкой фазы в газовую почти одинаковы, но коэффициент растворимости синильной кислоты значительно больше. Поэтому сероводород отдувается в ~100 раз быстрее и выделяется в первую очередь. От - дувочные газы первой ступени циркулируют в процессе и исполь-
|
1529 |
Получение роданидов натрия и аммония
Зуются для репульпации суспензии в сатураторе сульфата аммония (рис. 457). Воздух после сатуратора вместе с остаточными компонентами коксового газа и выделившимися парами поступает В водяной холодильник, где охлаждается с 95 до 30°. Полученный конденсат вместе с паро-газовой фазой направляется на промывку, где достигается очистка раствора от сероводорода. Выделившийся
Сероводород отводят из промывной башни в систему сероочистки или на сжигание или для других целей. Очищенный от сероводорода раствор направляется во вторую ступень, где дополнительным потоком воздуха отдувается цианистоводородная кислота, перерабатываемая далее в цианистый натрий.
При сероочистке газа мышьяково-содовым способом цианистые соединения переходят в роданиды (см. ниже). Из мокрых способов очистки для улавливания цианистых соединений наибольшее значение имеет
£ *
А IX }
|
IXJ |
Г* <х й |
Р <х |
|
|
Тз г> |
Н |
I 0) |
«а |
|
О On |
2 |
3 > О |
Юо о |
Рнс. 457. Схема получения синильной КнсдотаГ и сероводорода из сточных вод
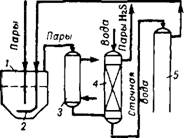
|
Воздух IcmyneHU Отдувки |
Коксового производства: /— сатуратору 2 —барботер; 3 — холодильник; 4 — промыватель; 5 и 6 — отдувочные колонны.
Промывка газа раствором железного купороса. Образующиеся при этом нерастворимые ферроцианиды отделяются в виде так называемого цианидного ила, являющегося сырьем для получения фер- роцианидов. Ферроцианиды образуются также при сухой очистке газов окислами железа и накапливаются в газоочистительной массе.
ПОЛУЧЕНИЕ РОДАНИДОВ НАТРИЯ И АММОНИЯ ИЗ ОТБРОСНЫХ РАСТВОРОВ МЫШЬЯКОВО-СОДОВОЙ ОЧИСТКИ ГАЗОВ
В процессе очистки водяного и коксового газов от сероводорода мышьяково-содовым способом цианистые соединения, содержащиеся в газе, переходят в роданиды:
HCN + NaHS + 'ДА = NaNCS + Н20
Основной побочной реакцией в этом процессе является окисление гидросульфида натрия и образование тиосульфата натрия (стр. 466):
2NaHS + 202 = Na2S203 + Н20
Для уменьшения количества накапливающихся солей в рабочем растворе часть его выводят из цикла и заменяют свежим. Из
Выведенного раствора выделяют тиосульфат натрия. В маточных растворах, остающихся после кристаллизации тиосульфата, содержатся 150—200 г/л ЫагБгОз и 300—350 г/л роданида натрия. Растворы обрабатывают серной кислотой для разрушения тиосульфата натрия:
3Na2S203 + H2S04 = 3Na2S04 + 4S + H20
При этом происходит разложение тиосульфата натрия на 90%, в то время как роданид разлагается лишь на 15—18% 94-
Разложение тиосульфата натрия производят при одновременном выпаривании раствора95. К нейтрализованному маточному раствору с тиосульфатной установки (или нейтрализованному для выделения мышьяка рабочему раствору мышьяково-содовой очистки) добавляют серную кислоту и нагревают его в выпарном аппарате до кипения. После 30—45-минутного выдерживания для лучшего разложения тиосульфата раствор выпаривают до содержания 520—580 г/л роданида натрия. При выпаривании раствора кристаллизуется сульфат натрия. При достижении концентрации NaNCS в растворе более 500 г/л, Na2S04 выделяется на 97—99%. Дальнейшим выпариванием повышают концентрацию NaNCS до 800 г/л, после чего при охлаждении раствора до 25—30° из него кристаллизуется двухводный роданид натрия. Выход роданида натрия составляет 60—70%. Полученный продукт содержит 0,2—0,5% тиосульфата и 1—4% сульфата натрия96.
Для получения роданида аммония раствор роданида натрия после первой выпарки, до отделения от сульфата натрия, обрабатывают сульфатом и хлоридом аммония. Затем раствор роданида аммония отделяют от осадка и подвергают концентрированию и кристаллизации.
Роданид аммония можно получить при промывке коксового газа суспензией серы 97 при 30—35° или раствором сульфида аммония, в котором предварительно растворено около 20% серы98.
Роданиды щелочных и щелочноземельных металлов можно также получить действием разбавленного раствора HCN на растворы сульфидов в смеси с серой или в смеси с высшими полисульфидами99. Для образования тонкодисперсной эмульсии или суспензии серы рекомендуется ввести в раствор ациклический спирт (например, метилциклогексанол) 100 или натриевую соль алкилиро - ванной нафталинсульфокислоты 101.