Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
БРОМ И ЕГО СОЛИ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Бром Вг2 — красновато-бурая жидкость, образующая бурье пары; плавится при —7,25°, кипит при 58,78°. Плотность жидкого брома 3,187(1—0,001086/) jГ/см3. Теплоемкость: кристаллов 0,0898 кал/г (—20,7°), жидкости 0,1071 кал/г (0—57°) и пара 0,0553 кал/г (83—228s). Теплота плавления 16,14 кал/г; теплота парообразования 44,8 кал/г. Коэффициент расширения 0,0011 на 1 градус (20—30°).
Бром растворим в воде и во многих органических растворителях— эфире, сероуглероде, четыреххлористом углероде, хлороформе, керосине. Растворимость брома в 95%-ной серной кислоте при 25° 0,75%• Растворимость воды в броме при 22°0,046%. Насыщенный водный раствор содержит при 760 мм рт. ст. 3,22—3,41% брома в интервале 20—50°. Из насыщенного водного раствора ниже 5,84° выделяется Вг-8Н20.
Константа гидролиза 1 брома
Вг2 + Н20 = НВгО + Н+ + Вг"
[НВгО] [Н+] [Вг~] [Вг2]
При 0° равна 0,7• Ю"9, при 20° — 5,2 • �~9 и при 35° — 11,3 • Ю"*.
При нагревании бромноватистая кислота переходит в бромно - Ватую:
ЗНВгО = НВгОз + 2НВг
Сульфаты и нитраты понижают растворимость брома в воде, я Хлориды и бромиды ее повышают, так как бром с ионами Вг - и Cl- Образует комплексные соединения:
Вгг + Br = BrJ; 2Вг2+Br"= Brg; Вг2 + СГ = Вг2СГ
Давление пара жидкого брома при 0° 66,9, при 20° 173, при 40° 392 мм рт. ст. Давление пара брома над его водными растворами подчиняется закону Генри — Дальтона при учете количества гид - ролизовавшегося брома или при подавлении гидролиза2-4. Коэффициент распределения брома Н (равновесное отношение концентрации брома в газовой фазе к концентрации его в растворе) для его водных растворов4 зависит от температуры:
T, °С........................ 0 10 20 30 40 50 60
Я............................. 0,0158 0,0287 0,0434 0,0653 0,0935 0,1275 0,1652
Бром сильно разрушает кожу; пары его даже в малых концентрациях разрушают слизистые оболочки. Предельно допустимая концентрация брома в воздухе 0,002 мг в 1 л; смертельная кон - "" центрация (при 30—60-минутном воздействии) 0,05 мг в 1 л.
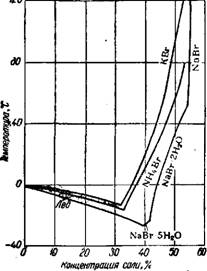
Бромистый натрий NaBr об - азует кристаллогидраты (рис. 8). Насыщенный водный раствор кипит при 121°. NaBr • 2Н20 кристаллизуется в моноклинной системе и имеет плотность 2,18 г/см3; безводная соль кристаллизуется в кубической системе, имеет плотность 3,2 г/см3 и Плавится при 755°.
Бромистый калий КВг кристаллизуется в безводной форме в кубической системе с плотностью 2,75 г/см3; температура плавления 730°.
Бромистый аммоний NH4Br Кристаллизуется в безводной форме в кубической системе с плотностью 2,43 г/см3. При 542° возгоняется, частично при этом разлагаясь.
|
Рис, 58. Растворимость бромидов Калия, натрия и аммония в воде. |
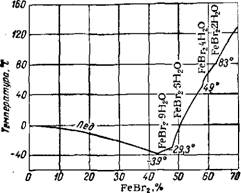
Бромистое железо FeBr2— кристаллы зеленого цвета, от присутствия бромного железа приобретают красный или красновато - бурый оттенок. Бромистое железо образует ряд кристаллогидратов 5 (рис 59). Насыщенный раствор FeBr2 кипит при 132°. Безводная соль кристаллизуется в гексагональной системе, имеет плотность 4,64 г/см3 и плавится при 684°; гексагидрат кристаллизуется в ромбической системе-
Бромноватокислые калий КВг03 и натрий NaBr03 кристаллизуются в безводной форме, при нагревании до 370—380° разлагаются с выделением кислорода. КВг03 образует кристаллы триго -
Нальной системы с плотностью 3,27 г/см3, NaBrOs — кубической системы с плотностью 3,34 г/см3.
ПРИМЕНЕНИЕ
Элементарный бром является исходным веществом для получения его органических и неорганических соединений. Бромиды применяют в медицине, фотокинотехнике, производстве некоторых красителей и фармацевтических препаратов. Для медицинских целей используют и многие органические соединения брома (бромалин, бромистую камфару, бромурал, ксероформ и др.). Броматы используют в аналитической химии (броматометрия) и в хлебопечении. Наибольшее количество брома и его солей (NaBr, FeBr2) применяют для синтеза бром - органических соединений, используемых в качестве антидетонирую - щих добавок к моторному топливу (бромистый этил, дибромэтан и др.), хладагентов (бромфреоны), огнетушащих средств (бромистый метилен), фумигантов (бромистые метил, этил и др). В США начали использовать бром для санитарной обработки воды. Расширяется применение бромидов для получения металлов высдкой чистоты,
|
Рис. 59. Политерма растворимости в системе FeBr2—Н20. |
Технический бром выпускают трех сортов, содержащих не менее 99,9, 99,7 и 99,2% брома; ГОСТ 454—70 регламентирует наличие в нем примесей хлора, сульфатов, воды, органических и нелетучих веществ. Перевозка и хранение жидкого брома требует соблюдения больших предосторожностей. Жидкий бром транспортируют в стальных баллонах емкостью 40—320 л, футерованных свинцом, или в специальных цистернах, плакированных никелем или футерованных свинцом. Тарой для малых количеств брома служат толстостенные стеклянные бутыли с притертыми пробками, защищенные от света 6~9. Осушенный жидкий бром (содержащий меньше 0,01% воды) можно транспортировать при температуре ниже 20—25° в баллонах из углеродистой стали (Ст. 3) и при 25—50° в баллонах из хромистой стали (1Х13)10'11. Для защиты нержавеющей стали рекомендуют12 добавлять в жидкий
бром малые количества двуокиси азота или крепкой азотной кислоты.
В СССР основным продуктом, в виде которого выпускается бром, является плав бромистого железа, состоящий из смеси четырех - и шестиводного кристаллогидратов. Согласно ГОСТ 9814—61, плав должен содержать не менее 49% брома, не более 3% хлора (от количества брома) и 0,3% Fe3+. Тарой для плава служат стальные барабаны с двойным швом емкостью 100—130 кг. "Продукт, более богатый бромом, — бромисто-бромное железо (Fe3Br8 • мН20), почти не выпускают из-за большой агрессивности по отношению к стальной таре. Бромистое железо может транспортироваться в обычных железнодорожных цистернах в виде концентрированных растворов (содержащих 31,3—33,6% Вг зимой и 35,2—38,1% Вг летом), если содержание Fe3+ в растворе не превышает 0,3%) и в него в качестве ингибитора добавлен уротропин (0,25%)13. При перевозке в футерованных цистернах уротропин не добавляют, а количество бромного железа в растворе не ограничивается.
Мировое производство брома в настоящее время находится на уровне 150 тыс. т в год (без СССР)'4-16.
СЫРЬЕ
Содержание брома в земной коре составляет ЬЮ-3 вес. %. Бром находится в природе в виде солей. Основными источниками Для промышленного получения брома являются: воды океанов, содержащие в среднем 67 г брома в 1 ж3; некоторые рассолы соляных озер и буровые воды нефтеносных районов, содержащие 0,2—3,5 кг брома в 1 ж3, а также маточные щелоки, получающиеся при переработке карналлита и сильвинита, содержащие 0,6—4,5 кг Брома в 1 м Все эти растворы помимо бромидов обычно содержат: СГ, SO2-, НСОз, СОГ, Na+, К+, Са2+, Mg2+, а также довольно часто Г, В4О7", HS~, S2", NH4, Fe2+, Мп2+ и органические вещества. Соленость рассолов колеблется от 30 до 390 г/л, а температура от —20° (озерные рассолы зимой) до 75° (высокотермальные буровые воды).
Извлечение брома обычно выгоднее производить из рассолов, более богатых бромидами. Но не только содержание брома в исходном сырье определяет экономические показатели процесса; практически очень важными факторами являются температура, соленость, щелочность и состав рассола. Так, при повышении температуры и содержания иона SO2-, а также при уменьшении солености (или при очень большой солености рассола) в процессе извлечения брома увеличивается давление его пара над рассолом и тем самым снижается расход пара или электроэнергии на производство. Повышение щелочности рассола увеличивает расход кислоты, требующейся для подавления гидролиза брома. Неблагоприятным фактором является наличие в рассолах веществ (HS~, S2_, NH+, Fe2+, Мп2+, органические вещества и т. д.), взаимодействующих с хлором, который вводится для окисления бромидов, ибо это связано с возрастанием его расхода. Присутствие в исходном рассоле органических веществ затрудняет извлечение, снижает выходы и загрязняет получающийся бром (из-за образования бром - и хлорорганических веществ), особенно при отгонке паром.