ТОЧКИ ЧЕРНОВА
Инженер Д. К. Чернов в 1866 году начал работу в сталеплавильном цехе военного завода в Петербурге.
|
Дмитрий Константинович Чернов (родился в 1839 году, умер в 1921 году). |
Почему одни пушки, выпускаемые заводом, прочны и долговечны, а другие быстро разрушаются? Не зависит ли прочность стали от её обработки? Вот вопросы, которые поставил перед собой инженер Чернов.
Первые же исследования убедили Чернова в том, что непрочная орудийная сталь всегда оказывается крупнозернистой. Но почему в одних случаях в стали образуются крупные зёрна, а в других — мелкие? Может быть, величина зерна зависит от режима ковки и закалки?
Чернов начал выяснять, что происходит со сталью при закалке. Он нашёл, что при нагревании сталь не остаётся неизменной: при определённых температурах меняются и размеры кристаллов (зёрен) и свойства стали. Эти температуры Чернов назвал критическими точками а и Ь теперь их называют точками Чернова.
В те времена ещё не было приборов для измерения высоких температур и наблюдения за режимом велись «на - глазок», по цвету нагретой стали. В точке а, например,
Сталь имела темновишнёвый цвет (около 700°), а в точке
Ь — матово-красный (800—850°). В своих лекциях по металлургии в Артиллерийской академии Д. И. Чернов приводит шкалу всех критических температур для стали:
Критический
200° 450° промежуток
D е а Ъ (х)к с
О ■ 1 I I ■ ■ II | | I _ I
Температура Температура (___ | Температура
Охлаждения полного Красное плавления
Для полней отпуска каление закалки
Какое же значение имеют эти критические точки?
Между точками х и с лежат температуры плавления различных сталей. Точка а — это та температура, при которой сталь уже способна принимать закалку. «Сталь, как бы она тверда ни была,— писал Чернов,— будучи нагрета ниже точки а, не принимает закалки», то-есть не становится более твёрдой при последующем быстром охлаждении в воде или в масле. «Сталь, нагретая ниже точки Ь,— писал далее Чернов, — не изменяет своей структуры, медленно ли или быстро после того она охлаждается... Как только температура стали возвысилась до точки 6, масса стали быстро переходит из зернистого (или, вообще говоря, кристаллического) в аморфное (воскообразное) состояние».
Позже было, однако, установлено, что при нагревании выше точки b сталь сохраняет кристаллическое строение, но кристаллическая решётка железа изменяется: из
кубической объемноцентрированной (альф а-железо) она превращается в кубическую гранецентрированную решётку (гамма-железо). Если такую сталь очень быстро охладить в воде, то структура стали снова резко изменяется. Под микроскопом мы увидим тёмные перекрещивающиеся друг с другом иглы (рис. 9). Это так называемый мартенсит. Он-то и придаёт стали очень высокую твёрдость и хрупкость после закалки. Мартенсит неустойчив и может распадаться даже при комнатной температуре, правда, очень медленно. При нагревании мартенсит распадается быстро.
 Структура мартенсита и условия его образования были тщательно изучены советским учёным, ныне членом-корреспон - дентом Академии наук СССР Г. В. Курдюмовым.
Структура мартенсита и условия его образования были тщательно изучены советским учёным, ныне членом-корреспон - дентом Академии наук СССР Г. В. Курдюмовым.
Точка (I — 200° — соответствует температуре охлаждения для полной закалки. До этой Рис- 9* Иглы мартенсита, гочки нужно быстро охлаждать
Сталь при закалке, чтобы сталь была твёрдой. При 200° в стали образуется мартенсит.
Закалённая сталь хрупка. Для устранения хрупкости сталь подвергается отпуску — снова нагревается до 200—600°, а затем охлаждается. При этом мартенсит распадается и из него выделяется смесь частиц почти чистого железа — феррита и химического соединения железа с углеродом — цементита. Чем выше температура отпуска, тем быстрее и полнее происходит распад мартенсита и тем крупнее выделяющиеся кристаллы феррито - цементитной смеси; чем выше температура отпуска, тем более мягкой и вязкой становится сталь.
Инструментальная сталь (для зубил, отвёрток, пил, резцов и т. д.) нагревается при отпуске обычно только до 200° — при этой температуре твёрдость понижается мало, но хрупкость устраняется в значительной степени.
Отпуск стальных пружин и некоторых штампов производят при температурах до 400—500°; при этом твёрдость заметно снижается и сталь становится пластичной.
Конструкционные стали, из которых делаются ответственные детали автомобилей, тракторов, самолётов, после закалки, как правило, подвергаются высокому отпуску, нагреваются до 550—650°. При этом сталь приобретает благоприятные сочетания прочности и пластичности; детали, изготовленные из такой стали, долговечны.
Точка е соответствует температуре 450°. Это — точка полного отпуска: мартенсит, сообщающий стали высокую твёрдость и хрупкость, при 450° распадается полностью.
Чернов изучил и режим ковки: болванку нужно нагреть до температуры 1200—1250°, и когда сталь станет пластичной, ковать её до тех пор, пока она не остынет до точки Ь (800—850°). При высоких температурах сталь имеет крупнозернистое строение, и если ковку кончить не в точке fr, а при температуре, допустим, 1000°, крупные зёрна останутся нераздроблёнными, и сталь получится непрочная.
Д. К. Чернов впервые в истории науки указал, что свойства сплава зависят от его внутреннего строения и, чтобы придавать сплавам те или другие ценные свойства, нужно подробно изучать все изменения, которые происходят при термической и механической обработке сплавов.
Значение работ Д. К. Чернова для науки о металлах и техники чрезвычайно велико. В 1900 году на Всемирной выставке в Париже французский металлург Поль 'Монгольфье обратился к собравшимся со следующими словами: «Считаю своим долгом открыто и публично заявить в присутствии стольких знатоков и специалистов, что наши заводы и всё сталелитейное дело обязаны настоящим своим развитием и успехом в значительной мере труду и исследованиям русского инженера Чернова».
Известный советский учёный А. А. Байков в статье, посвящённой столетию со дня рождения Д. К. Чернова, так оценивает значение работ Д. К. Чернова: «Д. К. Чернов является величайшим гениальным учёным, который своими замечательными исследованиями произвёл в металлургии полную революцию. Значение Д. К. Чернова для металлургии можно сравнить со значением Д. И. Менделеева для химии. Подобно тому как химия в своём дальнейшем развитии будет итти по пути, указанному Д. И. Менделеевым, так и металлургия стали будет развиваться в том направлении, которое было указано Д. К. Черновым».
Мы уже знаем, что сплавы — это кристаллические вещества, состоящие из атомов двух или нескольких химических элементов.
Сплавы получаются обычно путём сплавления либо металлов друг с другом, либо металлов с неметаллами. Расплавленные металлы обычно хорошо растворяются один в другом и дают однородный жидкий раствор. Так, медь растворяется в никеле, свинец — в сурьме. Получаемые таким путём сплавы называются литыми.
В настоящее время ряд сплавов получают также спеканием. Для этого из металлов, которые должны войти в состав сплава, приготовляют тонкие порошки, перемешивают их, прессуют, а затем спекают при соответствующих температурах и таким образом получают нужные сплавы. Спекание применяется иногда для получения подшипниковых сплавов (железа с графитом, железа со свинцом) и сплавов из тугоплавких металлов, например из кобальта и карбидов (соединений с углеродом) вольфрама и титана. Прессование и спекание смеси порошков производится в специальных пресс-формах, имеющих точную форму и размеры будущих изделий, и поэтому дальнейшая обработка сплавов оказывается ненужной.
Свойства сплава зависят не только от его химического состава, но и от внутреннего строения, структуры сплава. Поэтому в настоящее время при изучении сплавов строению их уделяется большое внимание.
Строение различных сплавов не одинаково. Составные части сплава могут образовать либо механическую смесь, либо химическое соединение, либо твёрдый раствор.
Что представляет собой механическая смесь?
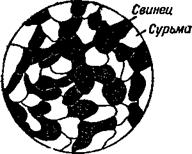
Если тщательно смешать порошок мела и порошок серы и посмотреть на полученную смесь в лупу, то можно увидеть отдельные зёрнышки мела и серы. Они не взаимодействуют друг с другом химически, а находятся в смеси в виде самостоятельных частиц. Подобные смеси и называют механическими. Такие смеси встречаются часто среди сплавов. Например, сплав свинца и сурьмы — механическая смесь. Если посмотреть на этот сплав в микроскоп, то можно различить мельчайшие кристалики свинца и сурьмы (рис. 10). Механические смеси может давать
Алюминий с кремнием, свинец с сурьмой, висмут с кадмием и т. д. В сплавах, которые состоят из механической смеси двух элементов, всегда можно подобрать только один определённый состав сплава, который имеет самую низкую температуру плавлеиия. Сплавы с таким составом называются эвтектическими или просто эвтектика м и (от греческого слова «эвтектос» — легкопла - вящийся). Для сплава свинца с сурьмой состав эвтектики— 87% свинца и 13% сурьмы, температура плавления её 246°.
 Металлы, образующие эвтектику, плавятся одновременно, при одной и той же температуре. Если же в сплаве один из металлов находится в количестве большем, чем это нужно для эвтектики, то он плавится при темпера-
Металлы, образующие эвтектику, плавятся одновременно, при одной и той же температуре. Если же в сплаве один из металлов находится в количестве большем, чем это нужно для эвтектики, то он плавится при темпера-
Рис. 10. Сплав свинца и сурьмы туре более высокой.
(схемз структуры). Меняя в сплаве весо
Вые количества отдельных элементов, можно получать сплавы с различными температурами плавления. Если, например, в 100 граммах сплава свинца с сурьмой содержится только 5 граммов сурьмы, то сплав плавится при температуре 296°, если сурьмы 10 граммов, температура плавления равна 260°, 20 граммов — 280°, 40 граммов — 395° и т. д. Весьма характерным для таких сплавов является то обстоятельство, что все они начинают плавиться вне зависимости от состава при температуре плавления эвтектики (246°), а заканчивают — при разных температурах.
Эвтектические сплавы очень ценны. Они представляют собой смесь чрезвычайно мелких кристаликов, имеют однородное строение и обладают сравнительно высокой прочностью и хорошими литейными свойствами, то-есть хорошо заполняют литейную форму и дают небольшую усадку (усадка — это уменьшение объёма отливки при переходе сплава из жидкого состояния в твёрдое).
Эвтектический сплав, содержащий 45,3% висмута, 12,3% кадмия, 17,9% свинца и 24,5% олова, плавится при 70°. Из него делаются электрические предохранители.
Эвтектические сплавы алюминия с кремнием — силумины — применяются для изготовления некоторых деталей в авиамоторостроении.
Познакомимся теперь с твёрдыми растворами.
Мы уже знаем, что расплавленные металлы могут растворяться один в другом: атомы одного металла равномерно распределяются в другом металле — растворителе. Это такой же процесс, как и растворение сахара в воде. При застывании сплава атомы растворённого металла так и остаются «рассеянными» в другом металле, и образуется твёрдый раствор.
Способность образовывать твёрдые растворы характерна для многих металлов. Железо, например, образует твёрдые растворы с углеродом, никелем, марганцем, кремнием и другими элементами; медь — с никелем, цинком, алюминием, кремнием; алюминий — с медью, магнием. Монеты, которыми мы сейчас пользуемся, являются твёрдыми растворами: одно-, двух-, трёх - и пятикопеечные монеты — растворы алюминия в меди; десяти-, пятнадцати - и двадцатикопеечные монеты — растворы меди в никеле.
В никеле может раствориться сколько угодно меди. Точно так же и в меди могут растворяться неограниченные количества никеля. (Конечно, когда в грамме никеля растворяется килограмм меди, растворителем считают не никель, а медь.) Однако такая неограниченная растворимость присуща далеко не всем металлам. Многие из них обладают ограниченной растворимостью. Свинец, например, плохо растворяется в цинке, в меди, в железе. Если расплавить вместе цинк и свинец, то образуется два жидких слоя: в верхнем слое будет жидкий цинк с небольшим количеством растворённого в нём свинца, а в нижнем — свинец, растворивший немного цинка. При затвердевании расплава оба эти слоя так и остаются один над другим.
В твёрдом растворе атомы растворённого металла «рассеяны» среди атомов металла-растворителя. Но ведь твёрдый раствор — кристаллическое тело. Как же построены в нём кристаллы?
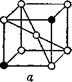
Рентгеновские исследования показали, что твёрдые растворы могут быть построены по-разному (рис. 11).
Если твёрдый раствор содержит металлы, атомы которых имеют приблизительно одинаковые размеры (диа-
Метры их различаются не больше, чем на 15%), то атомы растворённого металла не занимают каких-либо особых положений,— они могут замещать атомы растворителя в любом месте кристаллической решётки (рис. 11, а). Поэтому такие сплавы называются твёрдыми растворами замещения. Это наиболее часто встречающийся тип твёрдого раствора. Сплавы железа с хромом, никелем, марганцем, сплавы меди с никелем, кобальта с никелем образуют твёрдые растворы замещения. Если атомные диаметры металлов отличаются
 Друг от друга больше, чем на 15%, то твёрдые растворы обычно не образуются.
Друг от друга больше, чем на 15%, то твёрдые растворы обычно не образуются.
|
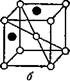
Рис. 11. Строение твёрдых растворов: а — раствор внедрения, б — раствор замещения. |
![]() Второй тип твёрдых растворов — это растворы внедрения. Они образуются чаще всего тогда, когда металл растворяет в себе неметаллический элемент, атомы которого значительно меньше атомов растворителя. Атомы растворяющегося элемента внедряются в промежутки кристаллической решётки между атомами растворителя, образуя твёрдые растворы внедрения (рис. 11, б). К сплавам, которые образуют такие твёрдые растворы, относятся сплавы железа с углеродом, азотом и т. д.
Второй тип твёрдых растворов — это растворы внедрения. Они образуются чаще всего тогда, когда металл растворяет в себе неметаллический элемент, атомы которого значительно меньше атомов растворителя. Атомы растворяющегося элемента внедряются в промежутки кристаллической решётки между атомами растворителя, образуя твёрдые растворы внедрения (рис. 11, б). К сплавам, которые образуют такие твёрдые растворы, относятся сплавы железа с углеродом, азотом и т. д.
Растворителем может быть не только чистый металл, но и химическое соединение. Так, например, химическое соединение алюминия с никелем может растворить в себе как никель, так и алюминий.
У твёрдых растворов есть одно замечательное свойство. Мы уже знаем, что атомы внутри кристалла находятся в непрерывном колебательном движении. Советские учёные А. Ф. Иоффе и Я. И. Френкель показали, что в то время, как один из колеблющихся атомов на какой-то момент времени покидает своё место в кристаллической решётке, соседний атом может проскочить на освободившееся место. В результате таких «перескоков» внутри кристаллической* решётки происходит непрерывное перемещение атомов, тем более оживлённое, чем выше температура сплава. На свободное место решётки, лежащей в поверхностном слое сплава, способны перескочить и атомы другого вещества,
Соприкасающиеся со сплавом. Эти «посторонние» атомы могут проникать, диффундировать и в глубь сплава, иначе говоря, растворяться в нём.
Способность сплавов-твёрдых растворов быть растворителями имеет громадное значение в технике. Во многих машинах и механизмах есть детали — коленчатые валы, шестерни, втулки и т. д., — сердцевина которых должна быть упругой и вязкой, а поверхность — твёрдой, прочной и стойкой к истиранию. Такие детали делают из вязкой и мягкой малоуглеродистой стали, а затем проводят следующую операцию. В железный ящик, куда насыпана смесь древесного угля с другими веществами, содержащими углерод (например, углекислым барием) кладут детали, плотно закрывают ящик и несколько часов нагревают его до 900—950°. После этого поверхность детали становится твёрдой и прочной. Почему это происходит? При высокой температуре углерод растворяется в поверхностном слое металла, и на детали образуется «корка» из твёрдой высокоуглеродистой стали. Насыщение поверхности металла углеродом называют цементацией.
Таким же путём можно азотировать сталь, то-есть насыщать её поверхность азотом (чтобы сделать сталь более твёрдой) »хромировать — насыщать хромом (чтобы сталь была твёрдой и химически стойкой) и т. д.
Иногда при сплавлении отдельные части сплава соединяются друг с другом химически. Так, например, вольфрам соединяется с углеродом, и в сплаве образуется новая составная часть — карбид. Кристалики химических соединений существуют в структуре сплава самостоятельно, как одна из составных частей механической смеси, или твёрдого раствора. Сплавов, которые состояли бы только из одних химических соединений, нет.
Кристалики химических соединений обычно обладают большой твёрдостью и хрупкостью. Особенной твёрдостью отличаются карбиды таких металлов, как вольфрам, хром, титан, ванадий, молибден. Поэтому они всегда находятся в структуре твёрдых сплавов и быстрорежущих сталей.
Мир сплавов весьма разнообразен. Среди них часто встречаются сплавы, которые, как мы уже видели, являются только механическими смесями, либо только твёрдыми растворами. Таких сплавов очень много среди простых сплавов, состоящих лишь из двух элементов.
В сложных сплавах — из трёх и более элементов — могут встречаться одновременно твёрдый раствор и химическое соединение, смесь чистого металла с его химическим соединением и т. д.
Для примера мы познакомимся с внутренним строением самого распространённого в технике сплава — стали.
|
Т° |
![]()
|
Жидкая сталь Д Начало эатверЯрЯпипс |
![]()
|
О 0,2 ОЛ 0,6 0,8310 И 1Л П % углерода ---------- |
![]()
|
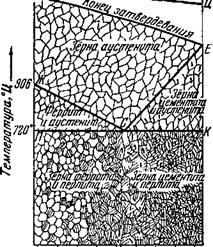
Рис. 12. Структура стали с разным содержанием углерода при разных температурах. |
![]()
 На рисунке 12
На рисунке 12
Изображена диаграмма состояния стали, которая показывает, как из - меняется структура стали в зависимости от содержания углерода (от 0 до 1,7%) и от температуры.
Выше линии АЦ сталь любого состава находится в жидком состоянии. При охлаждении по линии АЦ сталь начинает затвердевать, из расплава выделяются кристаллы а у с т е - н и т а. Аустенит — это твёрдый раствор цементита (химическое соединение углерода с железом) в гамма-железе. В области между линиями АЦ и АЕ в стали находятся и кристаллы аустенита и расплав. После затвердевания, то-есть ниже линии АЕ, сталь состоит только из зёрен аустенита.
Аустенит существует в структуре стали без каких-либо изменений лишь при высоких температурах (выше линии ЖСБ). При более низких температурах аустенит начинает распадаться.
Если в стали содержится менее 0,83% углерода, то при медленном охлаждении сплава часть аустенита превращается в почти чистое железо — феррит. Это происходит при температурах, которые соответствуют линии ЖС.
Когда температура стали достигнет 720°, зёрна аустенита окончательно распадаются и в сплаве образуется механическая смесь феррита с цементитом (химическим соединением железа с углеродом). Под микроскопом эта смесь имеет своеобразный перламутровый блеск и поэтому называется перлитом. При дальнейшем охлаждении в сплаве так и остаются зёрна чистого феррита и перлит.
Иная картина получается, если в стали находится больше 0,83% углерода. При медленном охлаждении такого сплава феррит не образуется. При температуре, соответствующей линии СЕ, из твёрдого раствора сразу выделяется цементит, а затем, при 720°, весь оставшийся аустенит превращается в перлит. Медленно охлаждённая сталь состоит из цементита и перлита.
В стали, содержащей 0,83% углерода, аустенит при охлаждении превращается полностью в перлит.
Свойства феррита, цементита и перлита различны. Зёрна феррита пластичные и сравнительно мягкие, как и чистое железо. Зёрна цементита, наоборот, очень тверды и хрупки, цементит прочен. Перлит по своим свойствам занимает среднее положение между ферритом и цементитом: он менее твёрд, чем цементит, и менее пластичен, чем феррит. Таким образом, меняя количество углерода в стали, можно изменять и её свойства. Сталь с небольшим количеством углерода — более мягкая и пластичная, чем сталь высокоуглеродистая.
Если сталь охлаждать быстро (это делается при закалке), то аустенит превращается в мартенсит — твёрдый раствор углерода в альфа-железе, имеющий, как мы уже знаем, игольчатое строение, высокую твёрдость и прочность.
