СОЕДИНЕНИЕ МЕТАЛЛОВ В ТВЕРДОЙ ФАЗЕ
ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ ДВИЖУЩИЕ СИЛЫ СХВАТЫВАНИЯ
Процесс схватывания металлов в твердой фазе можно представить как химическую реакцию, в результате которой между атомами соединяемых поверхностей образуются энергетически устойчивые конфигурации электронов [36]. Из теории абсолютных скоростей реакций известно [37 ], что любой протекающий во времени процесс характеризуется тем, что начальная конфигурация расположения атомов переходит в конечную через промежуточную, переходную конфигурацию, которая является критической для данного процесса и по достижении которой имеется большая вероятность завершения процесса (реакции). В этой связи вводят понятие активированного комплекса или активированного состояния. Активированное состояние атомов или их различных сочетаний по своей сущности является одним и тем же для многих процессов, наблюдаемых в твердых телах и связанных с атомными перегруппировками. Однако применительно к каждому конкретному процессу необходимо правильно определять понятие активированного состояния, ибо в противном случае нельзя дать четкого объяснения энергии активации такого процесса. В этой связи сразу же оговорим, что в общем случае под активированным состоянием атомов соединяемых поверхностей при схватывании в твердом состоянии следует понимать неравновесное электронное динамическое состояние поверхности, без которого не может быть осуществлено схватывание в твердом состоянии межц} двумя стационарными системами. Из этого определения следует, что неравновесное динамические состояние поверхностей — это переходный этап, а схватывание — это восстановление равноьесного состо чия через какой-т і вид неравновесного динамического состояния "поверхностей.
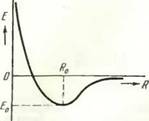
Проанализируем известную кривую изменения потенциальной энергии при сближении двух атомов одной природы в зависимости от расстояния между ними, которую в первом приближении можно рассматривать как кривую изменения потенциальной энергии при образовании двухатомной модели твердого тела (рис. 2).
Такие кривые выражают общий закон взаимодействия частиц и подразумевают установление между атомами в точке R0 химической связи. Взаимодействие частиц, однако, может иметь различный характер: связь между частицами в зависимости от их природы может быть ионной, ковалентной или металлической. Следует отметить, что при построении таких кривых подразумевают подготовленность сближаемых атомов к образованию химической связи, т. е. то, что они находятся в активном состоянии и по тому или
иному механизму образуют прочную химическую связь. Это не относится к тем случаям, когда происходит взаимодействие нейтральных в целом электрических систем (атомов или молекул), обусловленное действием сил В ан-дер - В аальса.
|
Рис. 2. Зависимость потенциальной энергии атомов Е от расстояния между ними R (Е0 — энергия связи атомов) |
Рассмотренный случай парного взаимодействия изолированных частиц не может быть распространен на взаимодействие двух связанных силами химического взаимодействия организованных систем частиц, какими являются поверхности конденсированных твердых тел. Различие, по-видимому, обусловлено тем, что поверхностные атомы твердых тел при их сближении не б) дут образовывать между собой химические связи, если какие-то активирующие факторы не переведут их в активное состояние, т. е. для их химического взаимодействия (независимо от того, является ли поверхность ювенильной или на ней имеется слой химически адсорбированного вещества) требуется некоторая избыточная энергия — энергия активации.
Рассмотрим гипотетическую модель схватывания двух идеальных кристаллов одной природы, решетки которых полностью когерентны (чтобы не требовалось подстройки атомов), а поверхности геометрически и атомно гладки и ювенильны. Примем также, что процесс соединения осуществляется при столь низких температурах, что диффузионная подвижность атомов и вероятность термических флуктуаций близки к нулю (в противном случае понятие идеального кристалла теряет физический смысл).
Определим состояние такой поверхности. Наличие сил зеркального изображения и асимметричный характер сил притяжения, воздействию которых подвержен пограничный атом со стороны нижележащих, ставит его в условия, абсолютно отличающиеся от тех, которые характерны для атомов в глубине кристалла. С одной стороны, связи поверхностных атомов с расположенными под ними атомами решетки сильнее, чем у атомов в центре кристалла. С другой стороны, поверхностные атомы проявляют склонность к установлению дополнительных связей с атомами или молекулами другой или той же самой природы. Условие равновесия межатомных сил атомов такой поверхности будет обеспечиваться за счет перераспределения их электронной плотности в некоторой зоне кристалла, прилегающей к поверхности. Характер такого перераспределения электронной плотности трудно предопределить, однако можно предполагать, что он обеспечивает минимальную потенциальную энергию системы поверхности атомов. Наличие потенциального барьера на такой поверхности обусловлено действием электромагнитного поля кристаллической решетки на электронные оболочки атомов поверхности, в результате чего они
И
должны быть деформированы полем («замкнуты» на объем) кристалла. Для протекания любого процесса (связанного с химическим взаимодействием) на такой поверхности атомы должны быть переведены в активное состояние, т. е. такое состояние, при котором перераспределение электронной плотности атомов в какой-то момент времени станет благоприятным для элементарного акта взаимодействия. Высокая реакционная способность таких поверхностей объясняется тем, что энергия, необходимая для перевода таких атомов в активное состояние, благодаря их стремлению к восстановлению симметрии поля сил, составляет относительно малую величину. Часто наблюдаемые «самопроизвольные» процессы на таких поверхностях представляются неактивируемыми в связи с тем, что средняя полная энергия, приходящаяся на атом кристалла в условиях опыта, становится сравнимой с высотой потенциального барьера для какого-то конкретного случая перераспределения и в связи с этим осуществляется с заметной скоростью [38].
|
|
|
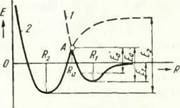
Рис. 3. энергии |
|
Зависимость потенциальной Е двух кристаллов от рас |
|
стояния между ними R: Ег — энергия ван-дер-ваальсовской связи; Е2 энергия химической (металлической) связи; энергия активации образования химической связи; Еа — кажущаяся энергия активации образования химической связи при некоторых условиях опыта |
Рассмотрим изменение потенциальной энергии системы, состоящей из двух кристаллов с описанными выше поверхностями, при их сближении (рис. 3). Кривая 1 показывает изменение потенциальной энергии системы двух поверхностей кристаллов, обусловленное действием сил Ван-дер-Ваальса. В точке энергия достигает минимального значения, прочность сцепления двух кристаллов в этом положении обусловливается значением энергии связи Еи которая относительно невелика и составляет 0,2— 2,0 ккал/моль [39]. Образование такого типа связи, применительно к рассматриваемой модели схватывания, можно трактовать как установление физического контакта между соединяемыми поверхностями. При дальнейшем сближении поверхностей соединяемых кристаллов начнут действовать силы отталкивания. Предположим, что, преодолевая эти силы, будем далее сближать атомы поверхности. Тогда потенциальная энергия системы будет изменяться по левой части кривой 1 в направлении точки А и далее. Для того чтобы в точке А между атомами двух поверхностей произошли обменные процессы электронного взаимодействия, необходимо, чтобы в процессе сближения атомы были активированы.
Если учесть, что для образования активированного состояния важно, чтобы большой запас энергии был сосредоточен на необходимой для процесса степени свободы, хотя общий запас избыточной энергии может быть и небольшим, то можно предположить, что энергия Еа, расходуемая на
преодоление сил отталкивания, может оказаться достаточной для перехода системы в состояние химического взаимодействия. Такая схема процесса наиболее вероятна при условиях, отличных от рассматриваемых (низкие температуры), ибо при относительно высоких температурах ввиду повышения среднего уровня энергии системы, процесс будет характеризоваться кажущейся энергией активации Е'а.
В результате установления между атомами соединяемых поверхностей на расстоянии между ними Д2 (примерно равном параметру кристаллической решетки) химических связей система достигает минимума потенциальной энергии Е2 и находится в равновесии. Граница раздела между двумя монокристаллами исчезает, ибо между атомами соединяемых поверхностей образуются энергетические устойчивые конфигурации электронов, присущие невозбужденным атомам внутри кристалла. Следует отметить, что кажущаяся энергия активации образования химической (металлической) связи Е'а для рассматриваемой гипотетической модели составила бы малую величину. Энергия, выделяющаяся при слиянии двух поверхностей, может даже превосходить энергию, необходимую для активации процессов химического взаимодействия, в связи с чем процесс представляется протекающим самопроизвольно, на что указывают некоторые исследователи [40].
От рассмотренной гипотетической модели слияния идеализированных поверхностей идеальных кристаллов перейдем к анализу схватывания реальных металлов. Для упрощения задачи рассмотрим вначале процесс соединения двух кристаллов, поверхности которых также атомно гладки, а кристаллические решетки полностью когерентны. Основным отличием такой поверхности от идеализированной будем считать наличие на ней моноатомного химически адсорбированного слоя окружающей среды, например кислорода. Иными словами, условие равновесия межатомных сил поверхностных атомов обеспечивается насыщением их свободных связей атомами кислорода. При этом в пределе будем считать, что обеспечивается ассоциация одного атома кислорода с каждым поверхностным атомом кристалла. Будем такую поверхность условно называть «полуреальной». Для анализа, аналогичного изложенному выше, необходимо также определить состояние такой поверхности. Такой анализ должен сводиться к выяснению природы связи в хемосорбированном слое, внутренняя поверхность которого состоит из атомов металла, а внешняя — из атомов кислорода, и к определению энергии такой связи. Известно, что связь, возникающая между кислородом и поверхностными атомами металла — ионно-ковалентная, причем такая связь характеризуется весьма высокой энергией (Си—О— 120 ккал/моль; Ni—О — 150 ккал/моль) н является функцией степени заполнения [41 ].
Рассмотрим процесс схватывания двух кристаллов с такими «полуреальными» поверхностями, представляющими собой электрически нейтральный комплекс адсорбции Me—О, для которого
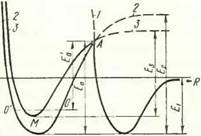
4. Зависимость потенциальной энергии частиц от расстояния между ними в случае:
|
кажущаяся энергия активации химиче |
1 — физической адсорбции атомов кислорода с атомами металла (Я, — энергия ван-дер-ваальсовской связи Me— О);
2 химической адсорбции атомов кислорода с атомами металла (в рассматриваемой модели взаимодействия каждая поверхность уже находится в состоянии, описываемом такой кривой;
— энергия химической связи
— О); 3 — химического взаимодей ствия атомов металла одной поверхности с атомами металла другой поверхности; Еа — энергия активации химической адсорбции атомов кислорода с атомами металла или энергия активации десорбции комплекса Me — О;
Рис.
ской адсорбции или десорбции при некоторых конкретных условиях опыта
изменение потенциальной энергии от расстояния описывается кривой 2 (рис. 4). При сближении их на некоторое расстояние установится равновесие молекулярных сил (сил Ван-дер-Ваальса) отталкивания и притяжения. При этом можно говорить о том, что между поверхностными атомами металла образовался физический контакт, т. е. между ними возможно химическое взаимодействие. Рассмотрим условия, которые должны быть выполнены для того, чтобы между поверхностными атомами металла, каждый из которых продолжает оставаться связанным с атомом кислорода, произошло химическое взаимодействие — образовалась металлическая связь.
Прежде всего необходимо определить понятие активного состояния для данного конкретного случая взаимодействия. Под активным состоянием атомов соединяемых поверхностей, валентные связи которых насыщены за счет атомов кислорода, следует понимать состояние, когда под воздействием каких-то активирующих факторов (или процессов в кристаллах, возникающих в результате действия этих факторов) в какой-то момент времени произойдет такое перераспределение электронной плотности атомов металла, которое может привести к временному ослаблению связей в комплексе химической адсорбции Me—О.
В этой связи полезно вспомнить, каким образом на ювенильной поверхности любого кристалла образуется комплекс химической адсорбции при взаимодействии атомов металла с атомами (а не молекулами) кислорода. Сначала образуется комплекс физической адсорбции, для которого изменение потенциальной энергии от расстояния описывается кривой 1 (рис. 4). Такая система в точке Ф будет находиться в состоянии равновесия и иметь минимум потенциальной энергии. Пусть затем система приобретет энергию Еа (или избыточную энергию Е'а), которая будет израсходована на перераспределение электронной плотности атомов металла и кислорода, необходимое для перевода их в активное состояние. Тогда она перейдет в состояние химической адсорбции,
2 Э. С. Каракозов 17
для которого изменение потенциальной энергии описывается кривой 2. В точке X система будет находиться в состоянии равновесия сил отталкивания и притяжения, а энергия связи этой системы характеризуется значением Е2 > Ег. В рассматриваемой модели взаимодействия кристаллов с «полуреальными» поверхностями изменение потенциальной энергии слоя поверхностных атомов металла с моноатомным слоем кислорода описывается именно кривой 2.
Исходя из понятия активированного состояния, для перевода атомов металла (в комплексе Me—О) в активное состояние необходимо разорвать связь между ними или, иными словами, осуществить десорбцию химически адсорбированного комплекса Me—О. Для начала этого процесса необходимо затратить энергию Е2, а далее процесс будет идти с затратой энергии активации десорбции Еа. Таким образом, процесс схватывания двух кристаллов, поверхности которых покрыты химически адсорбированным кислородом, можно представить следующим образом. Энергия системы комплекса Me—О, характеризуемая минимальным значением в точке X, при получении некоторой избыточной энергии изменяется по правой ветви кривой 2. Сообщаемая системе избыточная энергия расходуется на перераспределение электронной плотности в комплексе Me—О, что физически выражается в ослаблении связей между атомами металла и кислорода. Когда избыточная энергия достигает значения энергии активации десорбции (в точке А), связь между атомами металла и кислорода ослабевает настолько, что возможен ее полный разрыв. Если разрыв связей двух индивидуальных комплексов Me—О на каждой из соединяемых поверхностей произойдет синхронно, то, при условии удаления из зоны соединения атомарного кислорода, между атомами металла возникнет устойчивая электронная конфигурация, типичная для невозбужденных атомов в объеме кристалла. Энергия вновь образованного комплекса Me—Me изменится по кривой 3, которая достигнет минимального значения в точке М. Процесс образования прочных^ связей между атомами соединяемых металлов можно считать завершенным.
Проанализируем далее процесс схватывания двух монокристаллов, реальные поверхности которых геометрически и атомно неоднородны и имеют слой окислов. Рассмотрим строение окисного слоя на реальной поверхности монокристалла какого-либо металла. Согласно теории окисления для большинства металлов вначале наблюдается адсорбция (даже при низких температурах) и далее следует само окисление, скорость которого определяется значениями параметров процесса и природой металла. В этой связи будем различать хемосорбированный слой (как это было в случае полуреальной поверхности) и слой окисла определенного стехиометрического состава. Выше было показано, что связь, возникающая между кислородом и поверхностными атомами металла в хемосорбированном слое, ионно-ковалентная. Эта связь
отличается от связи кислорода с металлом в окисле того же стехиометрического состава тем, что она значительно сильнее. Тот факт, что величина теплоты адсорбции в большой части случаев выше теплоты образования окисла, указывает на то, что связь металл— кислород, от которой зависит стабильность комплекса адсорбции, энергетически более выгодна, чем связь металл—кислород в окисле. Это различие в стабильности оказывается основополагающим при оценке роли активных центров в процессе схватывания.
Рассмотрим поведение окисной пленки на металле при соединении в твердой фазе в вакууме, когда активирующим фактором взаимодействия является, в частности, температура. Необходимо ответить на вопрос, может ли воздействие температуры и вакуума привести к удалению окисла и десорбции кислорода с поверхности металла, т. е. может ли такая обработка приблизить рассматриваемую реальную поверхность к идеализированной ювенильной. Многочисленные данные свидетельствуют о том, что длительная обработка большинства металлов при высоких температурах и в вакууме не хуже 1СГ8 мм рт. ст. обеспечивает удаление с поверхности окисного слоя, но не обеспечивает получение абсолютно чистой (ювенильной) поверхности [411. Таким образом, процесс очистки металлической поверхности от окисной пленки не тождествен процессу разрыва связей (десорбции) металл—кислород в хемо - сорбированном слое, ибо диссоциация окисла энергетически более выгодна, чем разрыв связи металл—кислород. В этой связи термодинамические табличные данные, характеризующие условия стабильности окислов в функции температуры и давления и относящиеся к окислам, взятым в больших количествах, не могут быть применены к тонким пленкам толщиной порядка нескольких ангстрем. Следовательно, основным отличием рассматриваемой модели схватывания реальных поверхностей (в условиях сварки в вакууме с подогревом) от модели с «полуреальными» поверхностями является то, что реальные поверхности геометрически и атомно неоднородны.
Представим сближение двух реальных поверхностей, которые геометрически и атомно неоднородны и имеют слой химически адсорбированного кислорода, но не имеют слоя окисла, что соответствует состоянию поверхности при сварке в вакууме давлением с подогревом. Очевидно, что из-за наличия микронеровностей физический контакт развивается не одновременно по всей поверхности, а постепенно на отдельных участках, где напряжение выше среднего расчетного давления. Площадку контакта, образованную к некоторому моменту времени после соприкосновения поверхностей за счет пластической деформации двух противолежащих микровыступов, можно рассматривать в качестве аналога сближения двух «полуреальных» поверхностей после образования между ними физического контакта. В этой связи условия, необходимые Для образования металлических связей между атомами соединяемых поверхностей, аналогичны условиям, рассмотренным выше для
|
19 |
2*
случая взаимодействия «полуреальных» поверхностей. Очевидно, что и в этом случае химическое взаимодействие возможно при условии разрыва связей Me—О со стороны каждой поверхности и удалении из зоны соединения кислорода. Элементарными процессами, которые могут обеспечить выполнение указанного условия при соединении металлов в твердой фазе, вообще говоря, могут быть следующие.
1. Выход в зону физического контакта соединяемых поверхностей дефектов кристаллической решетки. При этом в некоторой области, прилегающей к месту выхода дефекта, может произойти разрыв связей Me—О. Следует особо подчеркнуть, что в этом случае, в зависимости от энергии и размера центра возмущения, в активированное состояние переходят не отдельные атомы, а большая их группа.
2. Термические флуктуации, когда атом металла в адсорбированном комплексе Me—О в какой-то момент времени получит энергию, достаточную для разрыва связи с кислородом.
Естественно, что дифференцированный анализ вклада каждого из указанных процессов в повышение энергии системы комплекса Me—О невозможен как из-за весьма сложной их взаимосвязи, так и из-за наличия в реальных кристаллах различного рода дефектов структуры. Так, например, дислокации могут порождать вакансии, которые в свою очередь способствуют движению дислокаций и отдельных атомов. Однако принципиально дифференциальную энергетическую оценку каждого из указанных элементарных процессов можно провести в двух аспектах. Первый касается оценки энергии, необходимой для образования и движения того или иного типа дефектов, второй — оценки энергии, выносимой тем или иным типом дефекта на поверхность (т. е. оценки мощности центра возмущения), в результате чего средний энергетический уровень атомов поверхности повышается. При этом значение энергии активации образования дефекта в существенной мере будет обусловливать частоту его зарождения и выхода в зону соединения.
Исходная плотность дислокаций в металле может быть различной в зависимости от его обработки. Обычно энергию накопленной деформации кристаллической решетки металла выражают через плотность дислокаций [42]. В условиях отсутствия воздействия активирующих факторов дислокации в металле закреплены При совместном воздействии температуры и давления в металле возникает пластическая деформация, скорость которой определяется плотностью потока движущихся дислокаций. Если пластическая деформация обеспечивается только движением старых дислокаций, т. е. условия процесса (температура и давление) таковы, что новые источники дислокаций не работают, то исходная плотность дислокаций характеризует возможный «ресурс» пластической деформации металла для данного исходного состояния. Если единичная дислокация, обеспечивающая элементарный акт пластической
деформации, выходит на поверхность металла в зону физического контакта и является центром возмущения, то она выносит некоторую избыточную энергию, тем самым уменьшая величину общей энергии накопленной деформации. Эта энергия, релаксируя в некотором объеме, прилегающем к месту выхода дислокации, повышает энергетический уровень атомов. Предположим, что в результате выхода дислокации на поверхность энергия п атомов, OKpj жающих место выхода дислокации, увеличилась на некоторую величину. Естественно, что эта энергия между п атомами распределена неравномерно в соответствии с характером распределения упругих искажений в поле дислокации. В результате этого только П] атомов из п приобретает энергию, необходимую для перехода в активированное состояние, т. е. для разрыва связей Me—О. Если остальные (п—п1) атомы рассматривать как изолированную систему, то можно говорить о том, что средний уровень их энергии на какой-то промежуток времени повысился и далее ввиду рассеивания энергии в объеме кристалла вновь достиг первоначального значения. Если частота выхода дислокаций (или то же, что частота появления центров возмущения) на поверхность невелика, то описанный процесс будет происходить в отдельных участках поверхности и средний уровень энергии системы поверхностных атомов сколько-нибудь существенно не повысится.
Если частота появления центров возмущения на поверхности велика, то средний уровень энергии системы поверхностных атомов может достигнуть какой-то определенной величины (например О'—О', см. рис. 4), которая в течение некоторого времени будет сохраняться. В этом случае для конкретного типа взаимодействия потребуется затрата кажущейся энергии активации Е'а (Е'а < Еа, см. рис. 3). Чем более высокий средний уровень энергии системы поверхностных атомов будет достигнут, тем меньшим значением кажущейся энергии активации будет характеризоваться рассматриваемый случай взаимодействия. Повышение средней энергии системы поверхностных атомов до определенного уровня можно рассматривать в качестве первой ступени взаимодействия.
При малых скоростях деформации и соответственно малых плотностях движущихся дислокаций переход атомов в активированное состояние будет происходить в отдельных участках поверхности, а само взаимодействие будет характеризоваться высокими значениями кажущейся энергии активации. При этом вероятность одновременного возбуждения атомов двух противолежащих друг другу поверхностей будет весьма низка.
При больших скоростях деформации частота появления в зоне физического контакта центров возбуждения может оказаться достаточной для того, чтобы в течение времени деформации поддерживать среднюю энергию системы поверхностных атомов на некотором уровне, отличном от уровня атомов в стационарном состоянии. В этом случае взаимодействие должно характеризоваться
малым значением кажущейся энергии активации. Аналитически это будет показано в гл. IV.
Активирующее воздействие давления и температуры на процесс образования прочных связей между атомами металла, свободные связи которого насыщены кислородом, заключается в использовании энергии, затрачиваемой на пластическую деформацию металлов в процессе сварки и энергии ранее накопленной деформации. Следует отметить, что все процессы, приводящие к активированию поверхностных атомов металла, происходят в небольшом объеме металла, прилегающем к зоне физического контакта. В предельном случае этот объем металла ограничен внутренней поверхностью зерен, непосредственно прилегающих к поверхности соединения. Из сказанного следует, что для образования соединения необходимо деформировать ограниченный приконтактный объем металла, однако в известных схемах сварки металлов это условие выполняется редко.