Водные щелочные силикатные системы
В настоящем разделе рассматриваются фазовые равновесия в системах М20—Si02—Н20, где M=Li, Na, К, причем основное внимание уделяется свойствам отдельных фаз и условиям их образования, так как, несмотря на химическое сходство катионов, фазовые диаграммы частных систем существенно различны.
Скорость достижения равновесия во всех рассматриваемых случаях сильно падает с понижением температуры, и поэтому высокотемпературные области (выше 100 °С) исследованы более полно, чем низкотемпературные. Системы с высоким содержанием кремнезема при комнатных температурах часто вообще не достигают равновесия и образуют множество метастабильных или термодинамически неравновесных состояний, многие из которых имеют практическую значимость. По этой причине высокомодульные системы рассматриваются здесь отдельно. Также выделены В самостоятельный раздел силикаты, производимые от органических оснований, ввиду их специфики, относительно недавнего, исследования и использования.
Так как технологические характеристики жидкого стекла тесно связаны со строением и физико-химическими свойствами растворов силикатов, последние также составляют отдельный раздел.
Система Na20—Si02—Н20. Эта хорошо изученная система отличается наибольшим разнообразием существующих кристаллических, аморфных и стеклообразных форм. Ее представители составляют основной объем производимых силикатов, а технология их производства насчитывает более полутора столетий. В основе многообразных кристаллических форм лежит ортокремневая кислота Si (ОН) 4, существующая в виде аморфного гидратиро- ванного кремнезема Si02-mH20. Известны ортосиликаты натрия всех степеней замещения этой четырехосновной кислоты. Все четыре ортосиликата натрия образуют множество кристаллогидратов, в состав которых входит до 8 молекул воды. Помимо двух варьируемых величин (степень замещения и количество кристаллизационной воды), кремнекислота может давать бесконечное множество поликремневых производных за счет образования силоксановых связей по суммарной реакции
= Si—'ОН + Н;—OSi=->-=Si—О—Si = + H20.
В гидротермальных условиях образования силикатов степень замещения водородов кремнекислоты ионами натрия в кристалле зависит от щелочности среды, которая определяется как силикатным модулем раствора, так и его концентрацией. Содержание; воды в кристаллических гидросиликатах натрия обусловлено! прежде всего температурой образования кристаллической фазы, а также концентрацией раствора, из которого образуется гидросиликат. Вода, сохраняющая химическую индивидуальность, встречается в структурах силикатов, образующихся в гидротермальных условиях при температуре ниже 160 °С [14]. Это главным образом молекулы воды, входящие в состав координационной сферы иона натрия или связанные водородной связью с кремне- кислородными анионами. Как видно из рис. 17, в системе ЫагЗЮз—НгО [15] с ростом температуры содержание воды в равновесной донной фазе быстро уменьшается, и при температуре выше 72 °С в равновесии с раствором находится безводный мета- силикат натрия. Все указанные на рисунке кристаллогидраты соответствуют двузамещенным ортосиликатам натрия, например Na2H2Si04-8H20 тождествен Na2Si03 • 9Н20. Растворимость всех кристаллогидратов быстро растет с повышением температуры, а безводного метасиликата натрия — уменьшается. Это происходит потому, что реакция образования силоксановой связи имеет относительно большую энергию активации, и скорость образования полисиликатных ионов с увеличением температуры существенно возрастает, что уменьшает растворимость в системе. Безводный метасиликат относится к поли - или цепочечным силикатам, в отличие от гидратных форм.
Поскольку скорость образования силоксановых связей в сильнощелочных системах при температуре ниже 100 °С мала, достижение равновесия раствора с цепочечными кристаллическими силикатами затруднено, и получить безводный метасиликат натрия гидротермальным путем при температурах 70—100 °С практически невозможно. Зато очень легко в этих условиях возникают пересыщенные метастабильные растворы с последующим переходом при испарении влаги в стекловидное состояние. Для образования более сложных равновесных полисиликатных кристалличе-
Рис. 18. Изотермы растворимости силикатов натрия в воде при
|
A W В Celes' Л Г 72,20* |
|
10 20 ЗО VI 50 60 70 80 NOjO'SlOj, «осс.°/ |
|
Рис. 17. Растворимость в системе Na2Si03—Н20 при различных температурах |
|
8) |
Различных температурах а — 30 °С, б — 50 °С; в — 90 °С
Na3HSUV2Hj,0
-- ---------- -
^^ ojh,0
--______ __o5h,0
— І^—^г-обНіб
-г - -^--E 8нго
|
Ад |
■--Tf^r---,
20 30
|
Jj> NajSiOj |
% sioг
NOiHSlOvZHjO

|
-^MaiOeSLOfllHtf |
|
10 20 30 «3 50 SO % SiOi |
M
-Г-д. ыр // каг0-2йрі
|
60 = 50 О Z 30 20, |
' 5НЛ'/ / ^
— ____ HdjHSUVH^
0 JO 20 JO W 50 % SC02
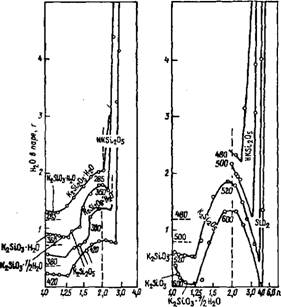
Ских структур нужны более высокие температуры, которые в присутствии воды требуют повышенного давления и достижимы в условиях автоклава. Изотермы растворимости для некоторых температур ниже 100 °С иллюстрируют приведенные соображения (рис. 18).
Наиболее обширную область существования при 30 °С имеет восьмиводный двузамещенный ортосиликат натрия Na2H2Si04-8Н20. Он относительно легко кристаллизуется из растворов при низких температурах (от 0 до 30 °С), может быть получен строго постоянного состава в очень чистом виде, так что используется как стандартное вещество. Как видно из рисунков, он кристаллизируется в довольно узкой области концентраций щелочи, но в широкой области концентраций по кремнезему. С понижением температуры до 10 °С область концентраций растворов, из которых кристаллизируется Na2H2Si04 • 8Н20, еще более возрастает. С увеличением концентрации Si02 в растворе сильно повышается
вязкость раствора, и достижение равновесия затрудняется. Лег кость образования Na2H2Si04-8H20 обусловлена тем, что ст'рук' турные элементы, из которых строится кристалл, имеются в раст воре в достаточной концентрации. Это правильные октаэдры аква комплексов иона натрия [Na (Н20)б] + и объединенные водородноі связью с двумя молекулами воды кремнекислородные тетраэдрь [ (НО) 2Si02 (Н20) 2] [14]. Катион и анион связывают толькі электростатическое взаимодействие и слабые водородные связц между молекулами воды, поэтому при низкой температуре (48 °С) кристаллическая структура разрушается и кристаллогидрат плавится в собственной воде. С увеличением концентрации щелочі (рис. 18, а) и возрастанием дефицита воды в координационную сферу атомов кислорода в кристалле, которая большей частьк тетраэдрическая, все чаще входят одновременно кремний и натрий, т. е. появляется связь Na—О—Si и в гидратных оболочках соответственно уменьшается число молекул воды. Возникают узкие области существования кристаллогидратов с уменьшающимся числом молекул воды, а температура их плавления соответственно повышается. При дальнейшем возрастании концентрации щелочи в растворе увеличивается концентрация анионов HOSiOl~ кристаллизации двузамещенных ортосиликатов натрия с числом молекул кристаллизационной воды меньше четырех не происходит, а возникают кристаллы Na3HSi04 • 5Н20. Характерно, что при концентрации Na20 выше 12—15 масс. % растворимость по кремнезему очень мала и падает с ростом щелочности (табл. 3). При более низких температурах это явление выражено еще резче. Точные данные по растворимости в системе Na20—Si02—Н20 при различных температурах, приведенные в табл. 3, содержатся в справочнике [16].
В области температур 50—70 °С Na2H2Si04 • 8Н20 и ряд других кристаллогидратов не выпадают в донную фазу, а образование безводных мета - или дисиликатов с силоксановыми связями кинетически затруднено. По этой причине при концентрации 15— 30 масс. % Na20 донную фазу составляют различные маловодные кристаллогидраты двузамещенного ортосиликата натрия, а выше »30 масс. % Na20 — трехзамещенного ортосиликата натрия. Области их существования тесно накладываются одна на другую, и практически тот или иной кристаллогидрат можно получить,
|
Масс. % |
Рис. 19. Полибарические равновесные изотермы системы Na20—Si02—Н20 при 200 °С [7]
|
'SlOj Д — днсиликат натрия Na2Si205; |
Ж — раствор; І} — кварц; М — NazSiCh;
Н„ — Na20-3Si02-IIH20
|
Таблица 3. Растворимость ■ системе Na20~Si02—Н20 ири 25 °С |16|
|
|
12,7 |
1,82 |
Na2Si03 • 9HsO |
|
18,2 |
1,42 |
— |
|
19,5 |
1,45 |
— |
|
19,7 |
1,33 |
— |
|
21,1 |
1,50 |
— |
|
22,2 |
1,47 |
— |
|
22,9 |
1,64 |
— |
|
24,9 |
1,88 |
. — |
|
26,5 |
2,14 |
— |
|
27,9 |
2,59 |
' — |
|
28,8 |
2,49 |
Na2St03 6Н20 |
|
30,3 |
2,50 |
— |
|
23,3 |
1,59 |
Na2Si03 5HsO |
|
24,6 |
1,51 |
— |
|
26,2 |
1,39 |
— |
|
27,3 |
1,54 |
— |
|
32,4 |
2,43 |
— |
|
27,8 |
0,76 |
Na3HSi04 ■ 5HjO |
|
29,2 |
0,47 |
— |
|
35,7 |
0,47 |
— |
Вводя в пересыщенный раствор соответствующие кристаллические затравки. При низкой (меньше 15% Na20) щелочности и высоком содержании кремнезема при этих температурах возможно образование кристаллов 3Na20-13Si02-11Н20 весьма низкой плотности [7]. Получение чистых кристаллических форм в этом температурном диапазоне затруднено. При 90 °С равновесие с раствором осуществляют только Na2Si03 и Na3HSi04 с одной или двумя молекулами воды. Область высокомодульных растворов не определена.
В области температур 200—400 °С, помимо метасиликатов натрия, на фазовых диаграммах появляются более богатые кремнеземом кристаллические структуры (рис. 19). При этом возникают условия для развития полимеризационных процессов и в системах с высоким силикатным модулем образуются кристаллы со сложным анионным составом вплоть до кварца. К слоистым силикатам относятся так называемый дисиликат натрия Na2Si20s и ряд гидратов трисиликата натрия Na20 • 3Si02• /гН20 (п= 5, 6, 11). Дисиликат натрия, так же как и метасиликат натрия, характеризуется обратной зависимостью от температуры, т. е. его растворимость с ростом температуры падает, что находится в соответствии со знаком теплового эффекта реакции растворения:
NasSiOaKp^NajSiCW
По уравнению изобары реакции следует:
DT RT2
Где as — активность метасиликата натрия в его насыщенном растворе; АН —. дифференциальная теплота растворения (см. в табл. 5 термодинамические свой - ства гидросиликатов натрия).
При 80 °С растворимость велика и Na2Si03 составляет около 60% массы раствора, а при 350 °С падает до десятых долей процента. Интересно, что при высоких температурах на полибарической фазовой диаграмме снова появляются гидратные формы, хотя при температуре 90 °С уже кристаллизовался безводный метасиликат натрия. Конечно, при высоких температурах молекулы воды, связанные только координационной связью с катионом или анионом, в кристаллогидратах донной фазы отсутствуют. С другой стороны, давление паров воды над раствором при температурах 200—300 °С велико, и в такой системе оказывается возможным существование гидратов силиката натрия с равновесным давлением водяного пара над ними не выше, чем над раствором. Некоторые наиболее известные гидросиликаты натрия, элементы их строения и ряд свойств сведены в табл. 4.
В табл. 4 прежде всего обращает на себя внимание зависимость температуры плавления от содержания воды в кристаллогидрате и резко отличающаяся температура плавления безводных форм. Если величину RTПл полагать мерой энергии, разрушающей кристалл, то легко заключить, что связи структурных элементов кристаллической решетки у кристаллогидратов в 2—3 раза меньше, чем у безводных систем: 320 R Дж/моль у наногидрата метасиликата натрия и 1360 R Дж/моль у безводного Na2Si03. В этом проявляется влияние силоксановых связей, отсутствующих в ор - тосиликатах натрия. Отсюда — кинетическая легкость растворения в воде гидратированных силикатов натрия по сравнению с безводными, хотя растворение безводных форм — экзотермический процесс, а растворение гидратов — эндотермический (табл. 5).
Из представленных в табл. 4 гидросиликатов натрия наибольшее промышленное значение имеет Na2H2Si04 • 4Н20. Это легкорастворимый гидросиликат с модулем 1, не отягощенный лишними молекулами воды и имеющий достаточно высокую температуру плавления, что создает удобство при транспортировке. Его получают в результате застывания расплава, соответствующего по составу этому соединению, затем дробят и измельчают. В гораздо меньшем количестве производят Na2H2Si04 • 8Н20 под названием девятиводный метасиликат натрия, а также двухводный силикат натрия Na3HSi03• 2Н20 с модулем 0,66. Первый кристаллизуется из соответствующих фазовой диаграмме растворов (см. рис. 18), лучше всего с модулем меньше единицы, при охлаждении
|
Таблица 5. Некоторые термодинамические свойства силикатов натрия [13) |
|||
|
Силикат иатрия |
Теплота плавления (25°С), кДж/моль |
Первая теплота растворения, кДж/моль |
Теплота гидратации, кДж/моль |
|
Na2Si03 Na2H2Si04 • 4Н20 Na2H2Si04 • 5Н20 Na2H2Si04 • 7Н20 Na2H2Si04 • 8Н20 |
52,3 30,7 67,0 |
—28,1 39,0 48,0 71,0 80,0 |
—68,0 —75,6 — 100 — 108,7 |
До 15 °С или ниже. В присутствии посторонних электролито» достаточно высокой концентрации для кристаллизации необходим ма затравка в количестве примерно 1 кг на 1 м3 [17]. Кристаллы других приведенных в табл. 4 кристаллогидратов ортосиликатов натрия также получают из соответствующих фазовой диаграмме пересыщенных растворов на кристаллических затравках.
Ортосиликат натрия (NaH3Si04), имеющий модуль 2, можно получить из двузамещенных гидросиликатов натрия обработкой метиловым спиртом [14].
Термические превращения гидросиликатов натрия имеют еле, дующие общие черты: 1) удаление воды происходит в широком| диапазоне температур, вплоть до 300—350 °С; 2) процесс этот, как правило, многоступенчатый с промежуточными полуаморфными фазами; 3) удаление конституционной воды сопровождается анионной поликонденсацией, называемой обычно полимеризацией. Так, двузамещенные ортосиликаты при нагревании в конечном итоге превращаются в Na2Si03 при ^«120 °С, однозамещенные ортосиликаты натрия полимеризуются до Na2Si205 в диапазоне температур 100—300 °С. Трехзамещенные ортосиликаты вначале) распадаются на две фазы Na2Si03 и Na20, а выше 400 °С образуется бисиликат натрия 2Na2Si03-|-Na20^>-Na6Si207.
Если нагреванию подвергаются кислые силикаты с конденсированными анионами, то конституционная вода теряется при высоких температурах, и процесс сопровождается длительной амор - физацией вещества [14].
Силикаты натрия традиционно относят к водорастворимым! веществам, и их практическое применение большей частью связано именно с этим свойством. Сравнительно недавно сначала обнаружили в природе, а затем получили синтетически высококремнеземистые гидросиликаты натрия (три последние формулы в табл. 4), отличительным свойством которых является их практическая нерастворимость в воде при обычных температурах. Макатит NaSi203(0H)3-H20 имеет слоистую структуру, а два другие: ма - гадиит NaSi70|3(ОН) 3• ЗНгО и кениатит NaSinO20,5(ОН) - ЗН20- относятся к цеолитам. Все они обладают хорошо выраженными ионообменными свойствами, и ионы натрия в них могут быть заме - ,цены на другие катионы (Н+, Li+, Mg2+, Ni2+) Без разрушения кристаллической решетки. Таким образом, при замене натрия на ион водорода можно получить кристаллогидраты кремневой кис - юты. Это означает, что у перечисленных гидросиликатов имеется прочный кремнеземный каркас и открытая для диффузии катионов структура. Каркас строится из крупных полисиликатных знионов, которые образуются в растворе силикатов натрия при его слабом подкислении, и для получения и сшивания анионов требуется температура 200—400 °С. Эти соображения легли в основу технологии получения цеолитов: автоклав плюс кислые добавки. В области полисиликатных кристаллических систем возможны новые открытия, если будут найдены способы создания в растворе высокой концентрации полианионов заданного вида.
Высококремнеземистые кристаллические системы переменного состава были синтезированы Дилером [2], Ильиным [18]. Например, Na20 (4—5) Si02(30—60) Н20, Na20 (9—16) Si02 (9—12) Н20 и Na20- 19Si02• 22Н20. Ильиным был также получен нерастворимый в воде силикат натрия состава Na20• 2,5Si02• Н20. В указанных работах кристаллы осаждали из растворов с меньшим силикатным модулем, чем модуль кристалла. Следовательно, образовавшиеся силикаты обладают некоторой устойчивостью в щелочных средах.
Помимо выделения кристаллических фаз, высокомодульные концентрированные системы способны к образованию аморфных стекловидных продуктов. Так, например, известно, что промышленные растворы силиката натрия (я>3) полностью затвердевают при хранении в закрытой таре в течение нескольких лет.
Получить кристаллический гидратированный кремнезем путем ионного обмена можно не только из кристаллических полисиликатов, но даже из безводных кристаллических метадисиликатов. Например, из p-Na2Si205 осторожным подкислением в растворе метилового спирта получают слоистую структуру гидратированно - го кремнезема формулы (H2Si205) . Айлер приводит другие многочисленные примеры получения из различных силикатов кристаллического слоистого гидратированного кремнезема разного строения, но того же состава (H2Si205)°° . Однако в отсутствии катионов водный кремнезем не кристаллизуется.
Таким образом, в системе Na20—Si02—Н20 кристаллические гидросиликаты могут иметь модуль от 0,5 в ортосиликате натрия До бесконечно большой величины в практически чистых кристаллических формах гидратированного кремнезема. При этом высоко - кремнеземистые формы часто имеют переменный состав.
Для рассматриваемой системы весьма характерны стеклообразные и аморфные образования. При высоком давлении пара безводные расплавы силикатов натрия хорошо поглощают воду без нарушения гомогенности системы. Содержание воды в расПлаве может достигать 10 масс. % и выше в зависимости от дав - Л©йия паров. Присутствие воды в расплаве резко уменьшает его
Вязкость. Затвердевают такие системы в стекловидные массы, при чем температура затвердевания падает иногда на несколько со градусов. Содержание воды можно увеличивать непрерывна варьируя температуру и давление, и соответственно с увеличение! воды гомогенная система плавно изменяется после охлажд^ ния — от хрупких стекол с высокой твердостью через вязкие плас тичные массы к подвижным растворам. Естественно, в зависимо сти от силикатного модуля и содержания воды некоторые состоя ния оказываются неустойчивыми и проявляют склонность к крис таллизации или образованию коллоидных систем. С другой сто роны, многие кристаллогидраты при нагревании плавятся, боль шей частью инконгруэнтно, и при охлаждении вязких расплавої легко переохлаждаются, образуя стекла. Оптические, механи ческие, электрические свойства таких стекол могут менятьсі в широком диапазоне в зависимости от состава.
Стекловидные образования получаются также при вьісьіханиі растворов, выпаривании, причем условия проведения процесс; могут существенно изменять свойства образующихся тверды; продуктов. Насыщенные растворы силикатов натрия при комнат ных температурах и несколько выше характеризуются вьісокоі вязкостью и склонностью к пересыщению. Пересыщенные рас творы без кристаллизации могут сохраняться длительное время Так, многим исследователям не удавалось получить при ^<120 °( безводный метасиликат натрия из каких-либо растворов [13]
Таким образом, система Na20—Si02—Н20 обнаруживает ис ключительное разнообразие возможных состояний, предоставляї широкий выбор технологу при варьировании необходимых свойств Следует добавить, что при высокой температуре и давленні все компоненты рассматриваемой системы, так же как и друга щелочных силикатов, довольно легко транспортируются чере; газовую фазу с парами воды, что необходимо учитывать в соот ветствующих технологиях.
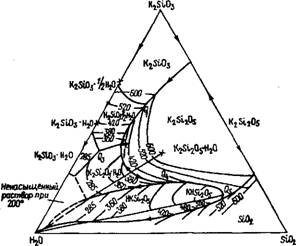
Система К2О—Si02—Н20. Фазовые равновесия этой системі во многом отличаются от натриевой, несмотря на то что двойнь» безводные системы близки между собой. Отличие определяете! особенностями гидратации ионов калия. Как известно, по сравне нию с солями натрия соли калия редко образуют кристаллоги/і раты. При обычных температурах для рассматриваемой системі они вообще не характерны, и поэтому там, где в натриевой систем' равновесной донной фазой является тот или иной кристаллогиД рат, в калиевой системе равновесной фазой остается кремнезем В натриевой системе область существования безводных силикатов в равновесии с растворами начинается примерно от 80 °С, хотя онї и труднодостижима из-за малой скорости образования силокса новых связей. В системе К2О—Si02—Н20 образование равновес ной донной фазы с силоксановыми связями между кремнекисло' родными тетраэдрами начинается выше 200 °С. Ниже этой темпе' ратуры равновесные с водными растворами силикаты калия вооб'
|
Рис. 20. Диаграмма фазового равновесия системы K2Si03— Si02— Н20 [15] |
Ще не существуют, они разлагаются водой с образованием аморфного кремнезема и раствора щелочи, концентрация кремнезема в котором отвечает насыщению.
На рис. 20 полибарические изотермы системы SiCb—Кг5іОз— Н20 для температур от 200 до 600 °С обозначены тонкими линиями. Жирными линиями без чисел ограничены области существования тех или иных силикатов, находящихся на линии в равновесии друг с другом, а также с жидкой и газообразной фазой (Q — точки сосуществования трех кристаллических фаз). В системе K^SiCb—Н20 при температуре 600 °С расплав почти не отличается по составу от кристаллической фазы К^Юз-'/2H20, но по мере охлаждения растворимость полугидрата сильно падает. Ниже температуры 380 °С донной фазой, находящейся в равновесии с раствором, будет моногидрат K2Si03-H20, который при температуре несколько ниже 200 °С не образует равновесий с растворами. При этой температуре линия равновесия фаз K2Si03- Н20 и K2Si205-H20 пересекает сторону треугольника НгО-КгЗЮз. С увеличением силикатного модуля (начиная примерно от 1,5) равновесной кристаллической фазой становится дисиликат калия. При температуре от 200 до 400 °С это моногидрат, при более высоких температурах — безводный Кг5І205. В области низких температур — менее 200 °С — дисиликат калия растворяется инконгруэнтно, т. е. по существу гидролизуется. Узкую область модулей, близкую к четырем, занимает тетрасиликат калия K2Si409-H20, или КНБігСЬ. Сам тетрасиликат растворяется конгруэнтно практически от 515 °С (его температура плавления) вплоть до 360 °С. Ниже этой температуры он разлагается с образованием аморфного кремнезема. При еще большем модуле системы равновесной донной фазой является кремнезем, а растворимость кремнезема очень сильно зависит от содержания K^SiOj в системе и от температуры.
Для наглядности на рис. 21 представлено изменение давления пара и состава донной фазы в системе КгЭЮз—БЮг. НгО при движении вдоль по изотермам рис. 20.
Рассмотрим изотерму 360 °С начиная от двойной системы K2SiC>3—Н20, где при этой температуре в равновесии с раствором находится моногидрат K2Si03-H20. При перемещении по этой изотерме вдоль кривой при модуле 1,04 наблюдается излом, отвечающий сосуществованию моногидрата и полугидрата с насыщенным раствором и паровой фазой. Затем до модуля 1,29 стабилен полугидрат, а в области 1,29—1,43 он сменяется дисиликатом калия. При еще больших модулях образуется гидрат дисиликата калия, стабильность которого сохраняется до модуля 2,27, а затем сменяется KHSi205. Последний устойчив до модуля 3,3, после чего силикат калия полностью гидролизуется, и дальше стабильна только кремнекислота. Давление пара над KHSi205 при прибли-
|
Рис. 21. Полибарические изотермы системы КгО—Si02—Н20 в координатах: давление насыщенного пара — силикатный модуль [15] Давление пара (ось ордииат) выражено через пропорциональную ему величину — число граммов воды в паровой фазе системы |
|
Таблица 6. Растворимость геля кремнекислота в растворах щелочей при различных температурах Mr Si02 на 100 мл раствора щелочи
|
|
Mr Si02 на 100 мл раствора щелочи при 40 °С
КОН 258 1750 3174 5164 6166 NaOH 276 1475 2532 4335 5873 |
Жении к области его сосуществования с кремнекислотой резко растет.
При понижении температуры фактором, определяющим стабильность фаз, будет усиливающийся гидролиз. Так, при 285 °С инвариантная точка, отвечающая сосуществованию моногидратов мета - и дисиликатов, отвечает модуль 1,13. При 200 °С она смещается до модуля 1,04, и стоит лишь незначительно снизить температуру, как этот модуль, отвечающий инвариантности, станет ниже 1,0, и метасиликат не может уже существовать в равновесии с раствором. Точно так же инвариантная точка равновесия K2Si20s-H20 и KHSi2Os с раствором при понижении температуры смещается в сторону низких модулей, при 200 °С она отвечает модулю 1,66. Это означает, что при температурах ниже 200 °С моногидрат дисиликата при растворении станет разлагаться.
В области температур до 100 °С были предприняты специальные усилия, чтобы достичь равновесия путем растворения тех или иных силикатов калия или определить хотя бы их метастабильную растворимость. Было установлено, что дисиликат калия растворяется в воде очень легко, a KHSi205 ведет себя как малорастворимое вещество. Сами растворяющиеся кристаллические фазы разлагаются водой с различной скоростью, и метастабильных состояний, относящихся к растворимости какой-либо метаста - бильной фазы, не удалось зафиксировать. Наиболее устойчивый при обычных температурах KHSi2Os нестабилен в водном растворе и постепенно превращается в аморфный осадок геля кремнекис - лоты, а жидкая фаза представляет собой разбавленный раствор, содержащий щелочь и кремнезем. Таким образом, концентрация насыщенного раствора в системе К20—Si02—Н20 при обычных температурах определяется растворимостью кремнезема в растворе щелочи. Данные по растворимости кремнезема в виде геля кремнеземкислоты в водных растворах КОН и NaOH приведены в табл. 6. Они относятся к способу насыщения, использованному авторами [19], и даются здесь как ориентировочные.
Строение и свойства некоторых силикатов калия даны в табл. 7.
Безводные мета - и дисиликаты калия являются, по данным [1], соответственно цепочечными и слоистыми структурами С ВЫСОКИМИ температурами плавления. Безводный тетрасиликат представляет собой кольца из четырех кремнекислородных тетраэдров, которые соединены силоксановыми связями. Плотность этого соединения аномально низка, она меньше, чем плотность стекла того же состава. Существенно ниже для него также температура плавления. Гидраты силикатов калия представляют, по существу, кислые соли сложных конденсированных анионов. Так, моногидрат дисиликата калия — это по своему строению кислый цикло - тетрасиликат (KHSi03)4, в котором соединение колец, находящихся в двух параллельных плоскостях, осуществляется водородными связями [14]. Моногидрат тетрасиликата КгО-4Si02-Н20 представляет собой кислый слоистый силикат калия, из которого можно осторожным подкислением получить кремнекислоту структуры (H2Si205) „о [2]. Оба кислых силиката могут быть получены гидролизом в метиловом спирте безводных структур K2Si03 и K2Si205 при 200 °С, только для получения (KHSi03)4 необходимо добавление КОН в метиловый спирт. Образование кристаллов кислых силикатов калия происходит в течение нескольких суток.
Силикаты калия, как и натриевые силикаты, способны к стекло - образованию в безводном и гидратированном состоянии. Безводные стекла могут быть гидратированы в той или иной степени без утраты стеклообразного состояния. Высокие степени гидратации характеризуются нарастанием пластичности и переходом в вязкие массы. С другой стороны, удаление влаги из растворов также позволяет получить стекловидные тела. По сравнению с натриевой системой, в соответственных состояниях стекла системы КгО—Si02— Н20 характеризуются большей вязкостью и гигроскопичностью. Для калиевых стекол характерна также более высокая скорость растворения в воде.
Гидросиликаты со смешанными катионами К и Na подробно не исследованы. В системе K2Si03—Na2Si03—Н20 кристаллизуется только силикат натрия. В четверной системе Na2Si03 — K2Si03—КОН—Н20 при комнатной температуре кристаллизацией из раствора были получены 3Na2Si03• K2Si03• 21Н20 и Na2Si03-3K2Si03-17Н20 [17]. Смешанные калиево-натриевые силикатные стекла, в том числе гидратированные, могут быть получены практически с любым соотношением катионов. Иногда частичное замещение катионов оказывается полезным для модифицирования технологических свойств при конкретном использовании жидких стекол.
Система Li20—Si02—Н20. В данной системе кристаллических гидросиликатов лития не обнаружено. Известные кристал - лические формы безводных силикатов лития Li4Si04 и Li2Si03 Не Растворяются в воде, а разлагаются водой с образованием гидра - тированного кремнезема. Ортосиликат лития, не растворяясь в хо-
Лодной воде, разлагается в кипящей. Метасиликат лития еще бо. лее стоек по отношению к воде и очень медленно разлагается ею [56]. Термодинамических равновесных состояний между безвод. ными силикатами лития и водой при температурах ниже 100 °С не обнаружено, и о растворимости как о равновесной концентраций силикатов лития говорить не приходится. В этом отношении рас - сматриваемая система ведет себя подобно системе К2О—Si02— —Н2О. Однако от последней силикат лития отличается большей водостойкостью.
При исследовании стеклообразных силикатов лития в качестве материалов одним из характерных изучаемых свойств является химическая устойчивость по отношению к воде и кислотам [6, 9].
Низкомодульные стекла (я<1) по результатам этих работ мало чем отличаются от кристаллических форм силикатов лития и постепенно разлагаются водой полностью. Для более высокомодульных стекол характерны процессы выщелачивания, переходящие с возрастанием силикатного модуля в поверхностный ионный обмен. Это свойство высокомодульных силикатов лития на поверхности обмениваться ионами с раствором позволяет использовать их в качестве ионообменных электродов. Полагают, что лонный обмен является первой стадией взаимодействия с водой силикатов лития любых модулей:
Ь$текло)+Н20^Н(1текло)+ЬЮНа,.
Эта реакция при низких модулях стекла полностью смещена вправо, а при высоких модулях образует на поверхности электрохимическое равновесие ионного обмена. В кислых средах аналогичная реакция практически необратима:
Ьі(+ЄкЛо)+Н30+-^Н(+екло)+Ьі+.
По данным [6], при обработке стекла состава Li2O-4Si0j раствором 0,1 н НС1 в течение 6 ч разрушается слой стекла толщиной 0,3 мкм. Для такого же стекла с модулем 2 при тех же условиях скорость выщелачивания возрастает в 4 раза. Введение в стекло небольших количеств AI2O3 увеличивает водостойкость.
Ион лития имеет по сравнению с другими ионами щелочных металлов малый радиус. Поэтому поляризующее действие Li+ очень велико, в то время как сам он поляризуется мало. В безводных средах для силикатов лития характерна связь Li—О—Si, обладающая высокой степенью ковалентности и по этой причине слабо поддающаяся воздействию дипольных молекул воды. Координационное число лития по кислороду обычно равно четырем, и реакция ионного обмена при взаимодействии с водой может являться лимитирующей стадией.
С другой стороны, в водных средах в силу того же поляризУ' ющего действия ион лития сильно гидратирован и, помимо первой координационной сферы из четырех молекул, он прочно удерЖЙ" вает вторую гидратную оболочку, поэтому гидродинамический „адиус иона лития в растворах наибольший по сравнению с радиусами ионов всех щелочных металлов. Энергия гидратации иона лития также наибольшая. Поэтому затруднен переход от гид - ратированных ионов лития в растворе к связям Li—О—Si в кристалле, и наоборот. В этом состоит основная особенность системы ц20—Si02—Н2О. Как известно, практически невозможно растворением безводных силикатов лития, кроме ортоформы, получить жидкое стекло в технологически приемлемой концентрации. Но и безводные силикаты лития из его водных растворов также не кристаллизуются при обычных температурах. По этой же причине растворением активных форм кремнезема в литиевых щелочах получают стабильные растворы, содержащие 10—20% Si02 и даже больше. Растворение в автоклаве при температурах 150—250 °С позволяет существенно ускорить процесс и использовать менее активные формы кремнезема. Однако при повышенных температурах в автоклаве модуль раствора оказывается не выше 2—2,5. Образовавшийся в автоклаве высокомодульный осадок, если кремнезема было взято больше, способен медленно растворяться в образовавшемся растворе при охлаждении, повышая его модуль. Известно также, что концентрированные растворы силиката лития при нагревании выше 80 °С выделяют белый аморфный осадок, который растворяется при охлаждении раствора, восстанавливая прозрачность. Состав осадка не соответствует определенному соединению, хотя некоторые исследователи полагают, что он содержит аморфный моногидрат метасиликата лития. Так или иначе, образование осадка свидетельствует, что при повышении температуры оказывается возможным ионам лития в некоторой степени дегидратироваться и перейти к связям Li—О—Si.
Образование связей Li—О—Si происходит не только при повышении температуры, но и при увеличении концентрации электролита, когда появляется дефицит воды и ее начинает не хватать для образования законченных гидратных оболочек. Так, например, скорость растворения кремнезема в растворах LiOH возрастает с увеличением концентрации щелочи до 2,5 н, а затем начинает падать. Понижение скорости растворения кремнезема имеет место при добавлении гидроокиси лития к концентрированным растворам натриевой или калиевой щелочи. В обоих случаях поверхность растворения кремнезема, вероятно, частично блокируется группировками Si—О—Li.
Одна из отличительных особенностей литиевых жидких стекол заключается в том, что они устойчивы по отношению к гелеобразо - ванию, коагуляции, кристаллизации в широком диапазоне модулей и концентраций. Используя силикагели или золи в качестве источника кремнезема при растворении в литиевой щелочи, можно получить жидкие стекла в области полисиликатов с модулями от 4 до 25. Непременным условием при этом является отсутствие Других катионов.
Растворы полисиликатов при очень высокой концентрации студнеобразны, однако при старении на холоде разжижаются.
Литиевая щелочь применяется также для стабилизации крем, незолей различной дисперсности. При этом образуются системы с высокими модулями, отличающиеся по свойствам от золей, стабилизированных иными щелочами. В частности, устойчивость таких золей сохраняется при частичном замещении воды органи - ческими растворителями. Гидроокись лития может быть использована также для модифицирования свойств растворов силикатов натрия или калия, или материалов на их основе.
Пленка, образующаяся после сушки литиевого жидкого стекла, отличается повышенной водостойкостью по сравнению с жидкими стеклами на иной основе. Недостаток воды, возникающий при высыхании, способствует образованию связей Li—О—Si. Увеличение температуры сушки значительно повышает водостойкость.
Полисиликаты лития используются наиболее широко в качестве связующего для антикоррозионных покрытий на основе цинка. Такие покрытия обладают высокой устойчивостью в морской воде, в различных грунтовых водах. Существует много вариантов цинковых антикоррозионных покрытий с использованием силикатов или полисиликатов лития, отличающихся различными добавками, модифицирующими то или иное свойство покрытия. Например, тонкие пленки силикатов лития служат для защиты оптических стекол.
Водостойкость красок на основе силикатов лития сохраняется и при использовании других наполнителей. Она обеспечивается не только образованием связей Li—О—Si, но и возможностью существенно повысить содержание кремнезема в связующем за счет увеличения модуля жидкого стекла. Широкому применению литиевых жидких стекол препятствует высокая цена лития и его соединений.