ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ
ПОЛЯРИЗАЦИОННЫЕ ЯВЛЕНИЯ ПРИ ЭЛЕКТРОЛИЗЕ
Прохождение тока через границу металл — электролит обычно сопровождается отклонением потенциала электрода от его равновесного значения. Это явление называется поляризацией. Различают два вида поляризации: концентрационную и химическую.
Концентрационная поляризация. Физическая сущность концентрационной поляризации может быть показана на примере электролиза. раствора азотнокислого серебра с серебряными электродами. До включения тока потенциалы обоих электродов равны равновесному значению. Прохождение тока через такую ячейку вызовет увеличение концентрации ионов серебра у анода вследствие растворения анода и уменьшение у катода, где происходит выделение серебра из раствора.
В результате этого потенциал анода смещается в положительную сторону, а потенциал катода — в отрицательную в соответствии с уравнением (26), т. е. возникает концентрационная поляризация. Образуется так называемый концентрационный элемент, э. д. с. которого направлена против приложенного напряжения.
При отсутствии концентрационного элемента для прохождения тока силой I ампер достаточно было бы напряжение Е, равное
E = IR, (27)
Где R — сопротивление электролита.
Уравнение (27) справедливо только в том случае, когда равновесные потенциалы обоих электродов равны. Если же электроды изготовлены из разных материалов и равновесные их потенциалы
Не одинаковы, то для электролиза (в отсутствии концентрационной поляризации) потребуется напряжение Еи равное
Где фа и фк — потенциалы анода и катода соответственно. Э. д. с. концентрационного элемента (Ее) равна
Где Дфа и Дфк — смещение потенциала анода и катода от равновесного значения в результате изменения концентрации ионов металлов в приэлектродных пространствах.
Для ведения электролиза при наличии концентрационной поляризации напряжения Е и Ех должны быть увеличены на величину Ек.
Обозначив их значения соответственно индексами, означающими
Поляризацию, получим
TOC \o "1-3" \h \z л£ = £ + £к = //? + Д? а-Д9к, (30)
ПЕ, =El^EK = ?a - ?к + IR + % - Д? к, (31)
Л^, = жра —л<рк+//?. (32)
Здесь пЕ и пЕ{ — соответствующие значения напряжения с учетом концентрационной поляризации.
Уравнение (32) показывает, что возникновение концентрационной поляризации вызывает увеличение напряжения, которое необходимо приложить к электродам для проведения электролиза.
Для уменьшения концентрационной поляризации применяют специальные меры, направленные к увеличению скорости подачи электролита из толщи раствора к электродам и отвода его от приэлектродных пространств. Положительное влияние в этом направлении оказывает повышение температуры электролита, так как при этом возрастает скорость диффузии ионов, а также интенсивное перемешивание электролита, осуществляемое различными способами.
Химическая поляризация. Электродная реакция обычно состоит из ряда стадий. Например, реакция выделения водорода при электролизе может быть представлена следующей схемой
H+^H-.H2f
Ион водорода разряжается на катоде, т. е. взаимодействует с электроном, и переходит в атомарное состояние. Затем два атома водорода объединяются в молекулу. Наконец, молекулы водорода, собираясь на поверхности электрода, отрываются и уходят с его поверхности в виде пузырьков газа.
Как уже отмечалось выше, прохождение тока через электролизер вызывает сдвиг потенциалов анода и катода от равновесных значений. Одной из причин этого явления служит концентрационная поляризация, рассмотренная в предыдущем разделе. Другой
Важной причиной возникновения поляризации служит затрудненность процесса разряда ионов, т. е. стадии взаимодействия ионов с электронами и превращения в нейтральные атомы.
Смещение потенциала, связанное с затрудненностью разряда, называется химической или электрохимической поляризацией.
Химическую поляризацию характеризуют величиной перенапряжения (ті), равной в случае катодных процессов разности равновесного потенциала электрода (фр) и значения потенциала при данной плотности тока (ф)
Рассмотрим химическую поляризацию на примере процесса разряда водорода.
П. в
1,7 -
|
Рис. 2. Зависимость электрохимической поляризации от плотности тока |
|
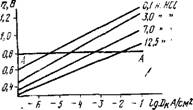
Рис. 3. Зависимость перенапряжения водорода на ртутном электроде от плотности тока в концентрированных растворах соляной кнслоты |
|
0,ч-_______________ -В ~ 5 ~ 1 -3-7 СдВкА/смг |
Перенапряжение водорода зависит от природы металла катода, плотности тока, температуры и состава раствора.
Зависимость перенапряжения водорода от плотности тока дается уравнением Тафеля
4=a + b\gDK, (34)
Где а — постоянная, зависящая от природы катода и состава раствора и равная величине перенапряжения при плотности тока, равной 1 А/см2; DK — плотность тока, А/см2; Ъ — постоянная, зависящая в основном только от температуры, равная при 25° С 0,11 — 0,12 В.
Значения а для свинца, цинка и меди в однонормальном растворе серной кислоты соответственно равны: 1,56, 1,24 и 0,80 В. Уравнение (34) показывает, что зависимость перенапряжения водорода от логарифма катодной плотности тока выражается прямой линией (рис. 2).
Зависимость перенапряжения водорода на ртутном катоде от концентрации соляной кислоты показана на рис. 3. Из рисунка видно, что с увеличением концентрации кислоты перенапряжение
падает. Так, например, при плотности тока 10~4 А/см2 перенапряжение водорода для 0,1 н ВСІ составляет 1,0 В, а для 12,5н НС1 — 0,5 В.
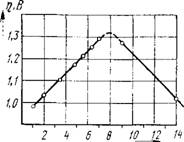
Следовательно, при одном и том же потенциале (например, при т] — 0,8 В) по мере увеличения концентрации кислоты скорость выделения водорода, т. е. величина DK, будет увеличиваться. Зависимость перенапряжения водорода от рН раствора показана на рис. 4. Как видно из рисунка, в кислых растворах перенапряжение
|
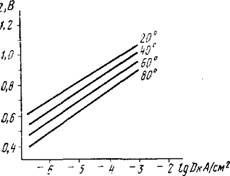
Рис. 5. Зависимость перенапряжения водорода на ртутиом электроде от плотности тока в растворах серной кислоты при различных температурах |
|
Рис. 4. Зависимость перенапряжения водорода на ртутном электроде от рН раствора при плотности тока 1-Ю-4 А/см2 |
|
DH |
Водорода с повышением рН раствора увеличивается, а в щелочных — уменьшается. Изменение перенапряжения при изменении рН на единицу составляет ~58 мВ.
Величина водородного перенапряжения снижается с повышением температуры. Это видно из рис. 5, где приведены данные, относящиеся к ртутному катоду в 0,25н растворе H2S04. Температурный коэффициент для металлов с высоким значением водородного перенапряжения (например, для ртути, свинца, кадмия, цинка) при средних значениях плотности тока (порядка Ю-3—10~5 А/см2) составляет 2—4 мВ на 1°. -
Явление перенапряжения водорода имеет важное значение в прикладной электрохимии.
Если выделение водорода является главной целью данного процесса (например, при электролизе воды), то желательно иметь минимальное значение г], так как рост перенапряжения связан с увеличением рабочего напряжения и, следовательно, с дополнительным расходом электроэнергии.
Существует, однако, много процессов, где высокое перенапряжение водорода очень желательно. Это относится к электродным процессам, где выделение водорода является побочным процессом.
В этом случае высокое значение і] уменьшает скорость выделения водорода и повышает выход по току для основного процесса.
Иногда же благодаря высокому перенапряжению водорода становятся возможными и процессы, которые без этого не могли бы иметь место, например электролиз раствора Z11SO4 с целью выделения цинка; зарядка свинцового аккумулятора и др. Таким образом, практика нуждается в электродах с высокими и низкими значениями перенапряжения выделения водорода, и задача инженерно-технических работников состоит в том, чтобы умело использовать закономерности реакции выделения водорода.
Электрохимическая поляризация (перенапряжение) в той или иной мере свойственна многим электродным процессам, встречающимся, в частности, в гальванической практике.
Так, опытным путем установлено, что выделение из растворов ті переход в раствор ионов цинка, ртути, кадмия, серебра в растворах простых солей этих металлов происходит правда с малым, но все же заметным перенапряжением. Выделение же из растворов и переход в раствор ионов железа, никеля и кобальта сопровождается очень большой поляризацией.
В заключение необходимо отметить, что наблюдающаяся на •практике величина поляризации является суммарным результатом сдвига потенциала, вызванного как концентрационными изменениями, так и замедленностью отдельных стадий собственно электродного процесса.