ПРОИЗВОДСТВО ХИМИЧЕСКИХ СОЕДИНЕНИЙ ТИТАНА
Титановые минералы, руды и рудные концентраты
В ряду распространенности элементов титан занимает девятое место, содержание его в земной коре 0,61 % (по массе). Титан встречается во всех изверженных и осадочных породах, а также в почве, торфе, каменном угле, растениях, крови, костях животных.
Титан встречается в земной коре в виде диоксида, тита - натов и сложных комплексных титанониобатов и силикотита - натов.
Известно около 70 минералов титана, наибольшее промышленное значение имеют рутил, ильменит, перовскит и сфен, являющиеся собственно титановыми минералами.
Рутил - природный диоксид титана (другие модификации - анатаз и брукит). Обычно содержит примесь оксида железа (II) FeO. Плотность 4,18-4,28 г/см3. Цвет большей частью красно-коричневый. Крупные месторождения редки. Известны месторождения в Австралии, Канаде, Бразилии. Рутиловые концентраты содержат 90-95% Ті02.
Ильменит - титанат железа Fe0-Ti02 наиболее распространенный минерал титана. Впервые найден на Урале в Ильменских горах. Минерал бурого или буро-черного цвета. Плотность 4,56-5,21 г/см3. При длительном выветривании ильменит переходит в аризонит (Fe203-3Ti02) и лейкоксен (Ті02*лН20). Это объясняет более высокое содержание Ті02 в некоторых ильменитах, чем это соответствует формуле FeO*ТЇ02 (52,66%).
Часто ильменит находится в тесной связи с магнетитом. Такие руды называют титаномагнетитами.
Ильменит добывают преимущественно из речных и прибреж- но-морских россыпей. Эксплуатируемые россыпи содержат от единиц до нескольких десятков килограммов ильменита на 1 м3 песков. Пески часто бывают комплексным сырьем. Так, пески Самотканского месторождения в Украине содержат рутил, ильменит, циркон, а также минералы алюминия - дистен
По структуре титанаты относятся к тнпу смешанных оксидов.
Al203-Si02 и ставролит Fe(OH)2-2AlSiOs.
Крупные россыпи ильменитовых песков найдены в Индии, Австралии, Индонезии, Африке, Южной Америке, США и СССР.
Важный источник ильменита - титаномагнетитовые месторождения. Крупнейшие из них известны в Канаде, СССР, Скандинавии, Бразилии.
Перовскит - титанат кальция Са0-Ті02 (58,7% Ті02). Часто содержит примеси ниобия, иттрия, марганца, магния. Плотность 3,95-4,04 г/см3. Цвет черный, красно-бурый.
Крупные месторождения найдены в СССР на Кольском полуострове. В перспективе может стать важным источником получения титана.
Сфен или титанит - титаносиликат кальция CaO- Ti02- Si02 (38,8% ТЮ2). Цвет желтый, плотность 3,4-3,56 г/см3. Месторождения найдены во многих районах СССР, известны в США, Канаде и Мадагаскаре. Может служить титановым сырьем при комплексной добыче с другими рудами (апатитом и нефелином).
При обогащении ильменитовых песков вначале гравитационными методами извлекают тяжелые минералы (магнетит, ильменит, рутил, циркон и др.), получая так называемые черные шлихи. Для разделения шлихов используют электромагнитные и электростатические методы. Бели магнитную проницаемость железа принять за 100, то для магнетита она равна 40,2, для ильменита 24,7, для рутила 0,4, для силикатов меньше 0,2. Изменяя напряженность магнитного поля, отделяют магнетит от ильменита, а последний от рутила.
Таблица 6. Примерный состав титановых концентратов, выпускаемых в СССР
|
Концентрат |
Состав концентрата, % (по массе) |
||||||||
|
ТЮ2 |
FeO |
Fe203 |
Si02 |
Аі203 |
Cr203 |
MgO |
CaO |
V2o5 |
|
|
Уральский |
44,0 |
31,4 |
16,9 |
1,8 |
2,5 |
- |
2,8 |
1,3 |
- |
|
Иршинский |
48,7 |
45,9 |
- |
3,9 |
0,5 |
- |
1,3 |
1,1 |
- |
|
Самотканский (аризонитов Ый) |
60,3 |
- |
25,3 |
1,2 |
2,0 |
1,4 |
0,9 |
0,2 |
- |
|
Рутиловый |
93,2 |
1,8 |
- |
2,0 |
1,1 |
0,3 |
- |
0,2 |
0,11 |
При обогащении титаномагнетитових руд с крупной вкрапленностью ильменита также используют магнитную сепарацию. Некоторые титаномагнетити не поддаются механическому обогащению. В этом случае применяют металлургическое обогащение - плавку в электропечах с получением чугуна и богатого титаном шлака. Из ильменитовых концентратов выплавляют шлаки с содержанием 75-85% Ті02. Кроме того, из них в результате химического обогащения получают синтетический рутил с содержанием 90-97% Ті02.
В табл.6 приведен примерный состав титановых концентратов, выпускаемых в СССР. Продукты переработки титановых концентратов
Из титановых концентратов непосредственно получают три вида продуктов: тетрахлорид титана, диоксид титана и фер - ротитан.
Тетрахлорид титана - основное исходное соединение для
Иломени/лодый концентрат Руталовый
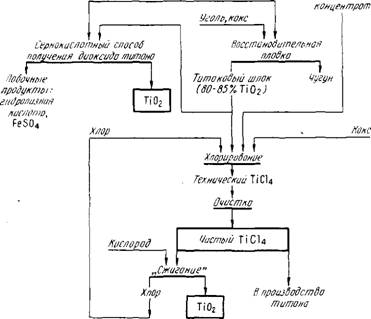
Ржс.39. Общая схема производства тетрахлорида титана и диоксида титана из ильменитового концентрата
Производства металлического титана. Для этой цели получают хлорид высокой чистоты, представляющий собой бесцветную (или слегка окрашенную в желтый цвет) жидкость. Диоксид титана выпускают различной степени чистоты: пигментный, содержащий 94-98,5% Ті02; повышенной чистоты (не ниже 99,5% Ті02) для производства твердых сплавов и металлического титана; для приготовления лигатур с никелем, медью, алюминием с содержанием Ті02 не ниже 99%; для обмазки сварочных электродов с содержанием не ниже 97,5% Ті02.
Ферротитан выплавляют из ильменитовых концентратов алюминотермическим способом. Сплавы содержат 25-30 % Ті; 5-8 % Al; 3-4 % Si; остальное - железо.
Ниже рассмотрены промышленные способы производства те - трахлорида титана и диоксида титана из основного сырья - ильменитовых концентратов.
На рис. 39 приведена общая схема переработки ильмени - тового концентрата. Видно, что хлорид титана производят хлорированием титанового шлака или "синтетического рутила", получаемых из концентрата. Диоксид титана производят двумя способами - сернокислотным или "сжиганием" тетрахлорида титана.
Выплавка титанового шлака из ильменита
Высокое содержание железа (40-48 % FeO + Fe203) затрудняет получение хлорида титана из ильменита. При прямом хлорировании концентрата на образование хлорида железа затрачивается много хлора, регенерация которого из хлорного железа затруднительна.
Для отеделения железа проводят восстановительную плавку ильменита с получением чугуна и титанового шлака (80-87% Ті02). Разделение титана и железа в этом процессе основано на большом различии сродства к кислороду у железа и титана.
Восстановительную плавку ведут в трехфазных электродуговых печах, подобных применяемым в производстве ферросплавов, мощностью 5-20 МВт (рис. 40). Ванна печи футерована магнезитовыми огнеупорами. Для защиты футеровки стен от быстрого разъедания шлаком на них предварительно наращивают гарниссаж - слой застывшего тугоплавкого шлака.
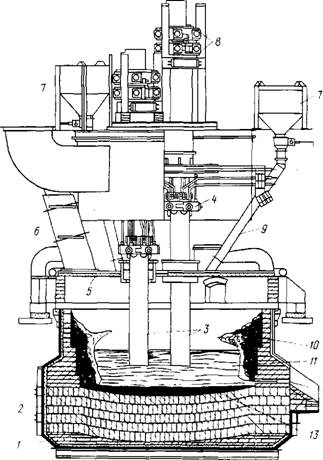
Ржс.4О. Схема электродуговой печи мощностью 5 МВт для выплавки титановых шлаков:
1 - кожух; 2 - футеровка (магнезитовый кирпич); 3 - электроды; 4 - токопод - водящие щеки; 5 - водоохлаждаемый свод; б - вентиляционная труба; 7 - бункера с шихтой; 8 - система подвески и перепуска электродов; 9 - труботечки для подачи шихты; 10 - гарниссаж; И - шлак; 12 - летка; 13 - чугун
Для защиты подины от разъедания на ней постоянно поддерживают высокий слой чугуна (~0,5 м). Внутренние размеры плавильного пространства печи: диаметр 4,55 м, глубина ванны 2,175 м.
Охлаждаемый свод печи - съемный. Герметизация печи осуществляется с помощью песочного затвора между основанием свода и кожухом печи. Через отверстия в своде в ванну вводят закрепленные в электрододержателях три гра - фитированных электрода (диаметром 0,5 м), связанные с системой их перепуска. Перепуск электродов приводится в действие по мере их выгорания при отключенной печи на высоту примерно 100-150 мм.
Плавку ведут с закрытым колошником, т. е. с дугами, закрытыми шихтой (электроды глубоко погружены в шихту). Шихту (концентрат в смеси с коксом) из бункеров по трубо - течкам загружают возле электродов и между ними. Плавку ведут на порошковой или брикетированной шихте. Применяют также комбинированную шихту из смеси брикетов и порошковой шихты.
При восстановлении ильменита в различных температурных интервалах протекают следующие реакции: примерно до 1240 °С:
FeO • Ті02 + С = Fe + Ti02 + СО,
З Ті02 + С = Ті305 + CO; (4.1)
При 1270-1400 °С
2 Ti3Os + С = 3 Ті203 + СО;
При 1400-1600 °С
Ті203 + С = 2 ТіО + CO.
В процессе плавки образуются сложные соединения, кристаллизующиеся при затвердевании шлака. Главное из них - аносовит, в основе которого промежуточный оксид Ті305. Состав аносовита можно представить общей формулой:
M[(Mg, Fe, Ті)0 • 2 TiOj • n[(Al, Fe, Ті)203 • TiOj.
В аносовите титан находится в состояниях окисления Ті4+, Ті3+, Ті2+. Кроме аносовита, а также некоторых других сложных соединений в шлаках может присутствовать ок - сикарбонитрид Ti(C,0,N), который представляет собой твердые растворы ТіС, ТіО и TiN, обладающие однотипной кристаллической решеткой. Оксикарбонитрид образуется при температурах выше 1600 С.
Низшие оксиды и особенно оксикарбонитрид повышают температуру плавления и вязкость шлаков. Эти параметры можно снизить добавками флюсов (CaO, MgO, А1203). Однако стремятся проводить бесфлюсовую плавку для получения более богатых по TiOz шлаков. Режим плавки включает загрузку шихты, набор электронагрузки до максимума, получение первичного шлака, его доводку, отстой и перегрев, выпуск шлака и чугуна. Количество углерода в шихте рассчитывают так, чтобы получать шлак с содержанием 3-5 % FeO.
Продукты плавки (чугун и шлак) обычно выпускают вместе через одну летку в общую изложницу. Температура шлака на выпуске 1570-1650 °С. После расслаивания и затвердевания чугун и шлак разделяют.
Расход электроэнергии при плавке в закрытых печах равен 1900 кВт-ч/т шлака.
Примерный состав шлаков, %: ТЮ2 82-87; FeO 3-6,5; Si02 2,8-5,6; CaO 0,3-1,2; Al203 2-6; MgO 2-5,6; MnO 1-1,5; V2Os 0,15; Cr203 0,2-1,7. Выплавить шлаки с содержанием FeO ниже 3 % трудно без добавок флюсов вследствие их тугоплавкости, обусловленной присутствием оксикарбида. При достаточном содержании FeO оксикарбид взаимодействует с ним по реакции:
ТіС ТіО + 3 FeO = Ti203 + 3 Fe + CO.
Характерная особенность блока титанового шлака состоит в том, что он рассыпается в процессе охлаждения на воздухе; это объясняется окислением низших оксидов с образованием рутила. Данное явление облегчает переработку блока.
Производство теграхлорида титана
Физико-химические основы процесса
Диоксид титана реагирует с хлором по эндотермической реакции:
ТЮ2 + 2 С12 = ТіС1„ + 02; АЯ°1000 к = 192 кДж,
AG°1000 к = 127,5 кДж. (4.2)
Даже при 800-1000 °С эта реакция протекает в незначительной степени вследствие малой величины константы равновесия:
A G° 30400
Lg *iooo к = " 2,3 R Т = ~ 4,576-1000 = "6'65;
*iooo к = РтіСіРо/Ра = 2,24-10"7.
4 2 2
Так как РТІСц = Р02, а суммарное давление газов Р02 + + ртісі4 + Pcii = 0,1 МПа, то PCh = 0,1-2 PTiCU.
Отсюда 2
РТІСІ
■ * (0,1— 2Pxict )г = 2'24'10"'
4
Определенное из этого уравнения равновесное парциальное давление ТіСІ4 для реакции (4.2) равно 47,8 Па, что отвечает объемной концентрации 0,05 %. Из этого следует, что реакция протекает в малой степени.
С достаточными для практических целей скоростью и выходом продукта при температурах 700-900 С хлорирование диоксида титана протекает в присутствии углерода. В этом случае хлорирование TiOz описывается суммарной реакцией:
ТЮ2 + С + 2 С12 = ТіС14 + С02. (4.3)
Реакция (4.3) - экзотермическая и протекает с большой убылью энергии Гиббса:
АЯ°1000 к = -218 кДж; А<?°1000 к = -273 кДж.
Константа равновесия реакции (3.3) при 1000 К:
2 14.2
К = Ртісі Рсо /Ра = 10 •
4 2 2
Кроме реакции (4.3) для расчета состава равновесной газовой фазы необходимо учитывать реакцию газификации углерода и реакцию образования фосгена:
С02 + С 2 СО; К = Рсо/рсо ; (4.4)
2
СО + С12 СОС12; К = Рсосі /РсоРсі • (4.5)
2 2
Равновесный состав газовой фазы можно определить, решив систему из пяти уравнений. Из них три - (4.3), (4.4) и (4.5) - выражают условия равновесия. Другие два уравнения вытекают из материального баланса и равенства общего давления ОД МПа:
Ртісі = Рсо + Лго/2 + рсоа /2;
4 2 2
Ртісі + Ра + Рсо + Рсо + Рсоа = ОД. (4.6)
4 2 2 2
В табл. 7 приведены результаты расчета состава равновесной газовой фазы.
Таблица 7. Равновесный состав газовой фазы для реакції хлорирован ая ТЮ2 в прнсутствжш углерода
|
Парциальное давление, МПа |
|||||
|
T, С |
СО |
Со2 |
ТІС14 |
С12 |
СОС12 |
|
600 700 800 900 |
0,017 0,041 0,0588 0,0653 |
0,0372 0,0193 0,0059 0,0015 |
0,0457 0,0397 0,0353 0,0336 |
4,37-10-» 1,13-10-» 2,41 • 10-9 9,93-10-9 |
5,63 • 10~13 4,98-Ю-12 6,37 • Ю-11 1,06-10"10 |
Можно видеть, что в интервале 600-900 °С равновесное давление хлора малое, что говорит о практической необратимости реакции хлорирования Ті02 в присутствии углерода. Равновесное давление фосгена на 2-3 порядка ниже давления хлора.
Исследования кинетики хлорирования ТЮ2 показали, что роль углерода не сводится лишь к связыванию кислорода в С02 и СО. Молекулы хлора, сорбируясь на поверхности углеродистого материала (угля, кокса), активизируются - переходят в атомарное состояние. Возможно также образование радикалов (С12 и др.) и хлороуглеродных нестойких комплексов СХС1Г Участие атомарного хлора, радикалов или хлороуглеродных комплексов в реакциях хлорирования ускоряет их протекание.
Ниже приведена возможная схема процесса с участием атомарного хлора:
I стадия - сорбция молекул хлора на угле или коксе с образованием атомарного хлора
[С12]адс ^ 2 [C1U 2 С1газ; (4.7)
Стадия - хлорирование Ті02 атомарным хлором при участии СО
Ті02 + 4 С1 + 2 СО = ТіС14 + 2 С02; (4.8)
Стадия - реакция газификации (реакция Будуара):
С02 + С 2 СО. (4.9)
Приведенная схема объясняет различия в скорости хлорирования ТЮ2 смесью хлора с СО при отсутствии и наличии угля. Находит также объяснение наблюдаемое резкое различие в соотношении С0/С02 в газовой фазе в зависимости от условий хлорирования. Когда скорость хлорирования лимитирует стадия газификации (4.9), состав газовой фазы будет близким составу для реакции хлорирования (4.8), т. е. в газовой фазе будет превалировать С02. Если же скорость процесса лимитируется стадией хлорирования (4.8), в составе газовой фазы при 800-900 °С будет преобладать СО в соответствии с равновесием реакции (4.9) (см. табл. 7).
При одинаковой температуре и крупности частиц скорость хлорирования шлаков выше, чем рутиловых концентратов. Это объясняется тем, что в составе шлаков содержатся низшие оксиды титана, которые активно реагируют с хлором при 300-400 °С даже при отсутствии углерода:
2 Ti3Os + 2 С12 = ТіС14 + 5 Ті02,
AG? ooo к = -431 кДж; (4.10) 2 Ті203 + 2С12 = ТіС14 + 3 Ті02,
AG? ooo к = -447 кДж; (4.11) 2 ТіО + 2 С12 = ТІСЦ+ Ті02,
AGiooo к = -548 кДж. (4.12)
Образующийся по реакциям (4.10)-(4.12) активный диоксид титана интенсивней хлорируется в присутствии угля, чем рутил.
В шлаках в тех или иных количествах содержатся кислородные соединения железа, марганца, магния, кальция, алю-
169
Миния, кремния, ванадия и других элементов. Летучие хлориды образуют Fe, Al, Si, V, Сг, Та, Nb.
По убывающей способности к взаимодействию с хлором оксиды можно расположить в ряд: К20 > NazO > СаО > (МпО, FeO, MgO) > Ті02 > Al203 > Si02. Естественно, что оксиды, расположенные в ряду до TiOz, в процессе хлорирования при 800-900 °С полностью переходят в хлориды, тогда как А1203 и Si02 хлорируются лишь частично (однако силикаты и алюмосиликаты хлорируются активно).
Практика хлорирования
В производственной практике применяют три способа хлорирования титансодержащих материалов: хлорирование брикетированной шихты, хлорирование в солевом расплаве и хлорирование в кипящем слое. Ниже рассмотрены первые два способа, используемые на отечественных предприятиях для хлорирования титановых шлаков.
Хлорирование брикетированных ш и х т. В этом варианте брикеты шихты хлорируют в шахтном хлораторе непрерывного действия. Для приготовления брикетов компоненты шихты (измельченные титановый шлак и нефтяной кокс) смешивают, к смеси добавляют связку (сульфитно-целлюлозный щелок, каменноугольный или нефтяной пек). Смесь прессуют на вальцевых прессах в подушкообразные брикеты размером 50x40*35 мм - С целью повышения прочности и удаления летучих составляющих брикеты прокаливают без доступа воздуха при 850-950 °С в прокалочных печах периодического или непрерывного действия. В шихту вводят примерно 20-25 % кокса (при содержании в шлаке 80-85 % TiOj).
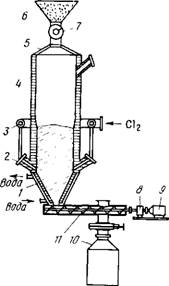
На рис. 41 приведена схема шахтного хлоратора непрерывного действия. Шахта хлоратора (внутренний диаметр 1,8, высота 10 м) футерована динасовым и плотным шамотным кирпичом. Брикеты подаются из бункера через золотниковый питатель, остаток выгружается шнеком или золотниковым уст-
Щелоки - отходы целлюлозных фабрик. Они содержат органические вещества. Сгущенные щелоки обладают вяжущими свойствами.
Ройством. Фурмы подачи хлора расположены на высоте ~2 м от выгрузки. Хлорирование проводят при 950-1000 °С.
В печах подобного типа можно хлорировать шлаки с низким суммарным содержанием СаО и MgO (не выше 4-5 %). При более высоком содержании образующиеся жидкие хлориды CaCL2 и MgCl2 приводят к слипанию брикетов и нарушению схода шихты вдоль шахты печи.
Расход хлора составляет 0,85-0,9 т на 1 т тетрахлорида титана, что выше теоретического расхода (~0,75 т хлора) вследствие затрат хлора на хлорирование соединений примесей. В хлоратор подается анодный газ магниевых электролизеров, содержащий ~85-90 % хлора или испаренный хлор из цистерн с жидким хлором.
При температурах 900-1000 °С хлорирование брикетов протекает во внешнедиффузионной области, т. е. скорость процесса определяется скоростью подачи хлора. Энергия активации процесса хлорирования ~12-16 кДж/моль Ті02. Брикет приведенного выше размера полно хлорируется за 3-3,5 ч.
Рнс.41. Шахтный хлоратор непрерывного действия:
1 - водоохлаждаемый конус; 2 - фурма; 3 - хлорный коллектор; 4 - корпус хлоратора; 5 - водоохлаждаемый свод; б - бункер; 7 - золотниковый питатель; 8 - редуктор; 9 - электродвигатель; 10 - сборник огарка; 11 - разгрузочный шнек
Парогазовая / смесь
При принятых режимах хлорирования процесс протекает за счет теплоты реакций. При расходе хлора ~400 кг/(м2 • ч)
высота реакционной зоны, в пределах которой концентрация хлора изменяется примерно от начальной вблизи фурм практически до нуля (у верхней границы зоны), равна 0,8-1,0 м.
Удельная производительность шахтных хлораторов непрерывного действия при температурах хлорирования 900-1000 °С равна 1,8-2 т ТіС14 на 1 м3 объема хлоратора.
Повышение единичной мощности шахтного хлоратора путем увеличения его диаметра нецелесообразно, так как возрастает неравномерность схода шихты (центральная часть брикета перемещается быстрей периферийной) и неоднородность температурного поля по его сечению (у стен температура выше вследствие неравномерности распределения хлора).
Отношение по массе С0:С02 в парогазовой смеси, выходящей из хлоратора, колеблется (в зависимости от режима) от 5:1 до 2:1.
Недостаток хлорирования брикетированной шихты - высокие затраты на приготовление брикетов, что повышает
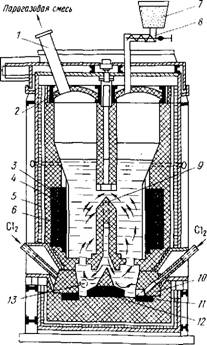
Ршс.42. Хлоратор для хлорирования в солевом расплаве:
1 - газоход; 2 - свод; 3 - графитовый электрод; 4 -
Стальные трубы для отвода тепла; 5 - кожух хлоратора; б - шамотная футеровка; 7 - бункер с шихтой,- 8 - шнековый питатель; 9 - перегородка для создания циркуляции расплава; 10 - фурма; 11,12 ~ донные графитовые электроды; 13 - нижний слнв расплава 10-15 % себестоимость хлорида; взрывоопасность отходящих газов, в которых преобладает СО.
Хлорирование в солевом расплаве. Этот способ разработан в СССР. Хлорирование шлака проводится в ванне из расплава хлоридов щелочных и ще - лочно-земельных металлов, куда подают компоненты шихты (измельченные шлак и кокс) и хлор. В качестве расплава используют отработанный электролит магниевых электролизеров, имеющий следующий примерный состав, %: КС1 72-76; NaCl 14-16, MgCl2 4-6. Шихта подается шнеком на поверхность расплава, хлор поступает в нижнюю часть хлоратора через фурмы и газораспределительную решетку (рис. 42). При удельном расходе хлора 40-60 м3/ч на 1 м3 расплава обеспечивается хорошее перемешивание его барботирующим хлором. В расплаве поддерживают концентрацию ТЮ2 2-3 %, углерода 7-9 %. При высоте расплава 3-3,2 м хлор успевает полностью прореагировать в объеме расплава, лишь незначительная часть его уходит с отходящимися газами.
Необходимая температура расплава (800-850 С) поддерживается за счет тепла экзотермических реакций. Избыточное тепло отводится с помощью установленных в стенке хлоратора кессонов из графитовых плит, в которые вмонтированы стальные трубы, куда подается вода.
В процессе хлорирования в расплаве накапливаются нелетучие хлориды (MgCl2, СаС12, а также FeCl2 и FeCl3 в форме комплексов KFeCl3 и KFeCl4 и др.). Периодически часть расплава выпускают и в хлоратор заливают свежий расплав. Отработанный расплав содержит, %: КСІ 30-40, NaCl 2-5, MgCl2 25-35, FeCl2 + FeCl3 + MnCl2 10-20, Si02 3-6, CaCl2 2-4, С 7-9, Ti02 0,5-1. В отличие от хлорирования брикетированных шихт в хлораторах с расплавом в составе парогазовой смеси преобладает С02 [объемное соотношение С02: СО = (Ю-5-20):1], что объясняется неблагоприятными условиями для взаимодействия С02 с частицами углерода.
Механизм (стадии) хлорирования диоксида титана в сложной системе, содержащей газовую, жидкую и две твердые фазы (Ті02 и кокс), недостаточно изучен.
Очевидно, что с поверхностью частиц кокса и Ті02,находящихся в расплаве, могут вступать во взаимодействие только растворенные в расплаве хлор, С02 и СО, так как при хорошем смачивании кокса расплавом его поверхность экранирована жидкой средой от непосредственного контакта с пузырьками газа.
Растворимость хлора, СО и С02 в расплавах KCl-NaCl - - MgCl2 при 800-900 С равна примерно 0,04, 0,02 и 1,5 г/л соответственно. Растворимость Ті02 не превышает 0,05 г/л. Согласно одной из предложенных схем растворенный хлор хемосорбируется на поверхности частиц углеродистого материала с образованием активного (атомарного) хлора, переносимого через расплав к поверхности оксида, где при участии растворенного СО протекает реакция:
Ті02 + 4 С1акт + 2 СО = TiCl4 + 2 С02.
Далее С02 частично взаимодействует с углеродом с образованием СО. Эта схема объясняет наблюдаемое повышение скорости хлорирования с увеличением удельной поверхности кокса и преобладание С02 над СО в газовой фазе.
Присутствие хлоридов железа в расплаве повышает скорость хлорирования. Это объясняется хлорирующим действием FeCl3, легко отщепляющего активный хлор. Как указано выше, хлориды железа находятся в расплаве в форме комплексов FeCl7 и FeCl7- Поэтому хлорирование ТЮ2 с участием хлоридов железа можно представить суммарными реакциями:
4 FeCl7 + 2 С12 = 4 FeClT; (4.13)
4 FeCl7 + Ті02 + 2 СО = ТіС14 + 4 FeCl7 + 2 C02. (4.14)
Таким образом, хлориды железа выполняют роль переносчиков хлора.
Поскольку хлориды железа хорошо растворимы в расплаве, концентрация хлорирующего агента будет зависеть от содержания в нем железа. Так, достаточно содержания 1 % FeCl3 в расплаве для существенного увеличения скорости процесса. При нормальной работе хлоратора (без проскока хлора) в расплаве устанавливается отношение FeCl2:FeCl3 = 20-5-200 (по массе), причем концентрация FeCl2 находится в пределах 15-20%, a FeCl3 0,1-1,0%.
Вследствие образования комплексов большая часть железа (а также алюминия, образующего комплекс КА1С14) остается в солевом расплаве.
Основные преимущества хлорирования в солевом расплаве по сравнению с хлорированием брикетов следующие: исключены ;сложные операции подготовки брикетов, что снижает себестоимость хлорида. Возможно хлорирование шлаков с повышенным содержанием СаО и MgO. Быстрый тепло - и массообмен в расплаве обеспечивает высокую скорость хлорирования и возможность отвода избыточного тепла. Преобладание СОг над СО в составе газов резко снижает их взрывоопасность.
К недостаткам хлорирования в расплаве следует отнести периодический вывод отработанного расплава (до 200 кг на 1 т ТіС14), с которым теряется часть титана. Хлориды - вредные производственные сбросы. Важная задача - их использование или регенерация с возвратом в процесс.
Пылеулавливание и конденсация хлоридов
Парогазовая смесь, выходящая из хлораторов, имеет сложный состав. Она содержит газы (СО, С02, СОС12, N2, НС1, С12), низкокипящие хлориды - в нормальных условиях жидкости (TiCl4, SiCl4, VOCI3 и др.); низкокипящие хлориды - в нормальных условиях твердые (FeCl3, А1С13); высококипящие хлориды СаС12, MgCl2, FeCl2, а также КС1, NaCl (при хлорировании в расплаве). Высококипящие хлориды механически увлекаются парогазовым потоком в виде тумана.
На рис. 43 приведена распространенная схема пылеулавливания и конденсации. Она состоит из пылевых камер (кулеров) для улавливания твердых хлоридов; рукавного фильтра с рукавами из стеклоткани для дополнительной очистки парогазовой смеси от твердых частиц; двух оросительных конденсаторов (конденсаторов смешения) для жидких хлоридов (TiCl4, SiCl4), орошаемых охлажденным тетрахлоридом титана; во втором конденсаторе тетрахлорид, поступающий на орошение, охлаждается до -10 С. Далее газы проходят санитарный скруббер, орошаемый известковым молоком, для улавливания небольших количеств хлора, фосгена, хлористого водорода и выбрасываются в атмосферу. В кулерах газы охлаждаются с 500-600 до 140-180 °С омывающим трубы воздухом. В нижней разгрузочной части кулеров поддерживается постоянная температура (120-130 °С) органическим теплоносителем, циркулирующим в рубашке разгрузочного корыта. Термостатирование рукавного фильтра (140-160 °С) также осуществляется жидким теплоносителем.
Вода Рассол
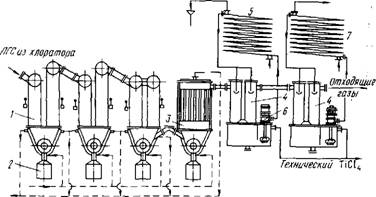
Fic.43. Схема раздельной конденсационной системы (пунктиром показан путь циркуляции теплоносителя):
1 - пылевые камеры (кулера); 2 - сборник твердых хлоридов; 3 - рукавный фильтр; 4 - оросительные конденсаторы; 5 - водяной холодильник; 6 - погружной насос; 7 - холодильник, охлаждаемый рассолом до -10 С (раствор СаС12)
Для снятия с рукавов из стеклоткани уловленной пыли производится их отдувка парами тетрахлорида титана.
В связи с осложненностью эксплуатации фильтров с рукавами из стеклоткани на некоторых предприятиях они заменены солевым расплавом NaCl + КС1 (см. рис. 25). Расплав циркулирует с помощью аэролифтного устройства. Принцип работы солевого фильтра рассмотрен в гл. 2.
Извлечение титана из шлака в жидкий технический тетра- хлорид составляет 92-93 %.
Очистка технического тетрахлорида титана
Содержание примесей в техническом TiCl4 колеблется примерно в следующих пределах, % (по массе): Si 0,01-0,3; Al 0,01-0,1; Fe 0,01-0,02; V 0,01-0,3; TiOCl2 0,04-0,5; СОС12 0,005-0,15; СІ 0,003-0,08; S 0,01-0,08.
Кроме перечисленных, в хлориде титана часто содержатся примеси хлоридов ниобия, тантала, хрома и примеси органических соединений, например ацетилхлориды (СС13СОС1, СН2С1СОС1), гексахлорбензол С6С16 и др.
Хлорид титана очищают от большинства примесей ректификацией, основанной на различии температур кипения хлоридов. Однако ректификации предшествует очистка от примеси ванадйя.
Очистка от ванадия. Ванадия содержится в ТіСІ4 в составе оксихлорида VOCl3. Отделение его от TiCl4 ректификацией затруднительно вследствие близости точек кипения TiCl4 и VOClj (136 и 127 °С соответственно). Все известные методы очистки от ванадия основаны на восстановлении VOCl3 до малорастворимого в тетрахлориде титана VOCl2. На отечественных заводах в качестве восстановителей применяют медные или алюминиевые порошки.
Восстановление медным порошком протекает через стадию образования CuTiCl4:
Си + TiCl4 = CuTiCl4; (4.15)
СиТіС14 + VOCl3 = VOCl2 + CuCl + TiCl4. (4.16)
Получаемые медно-ванадиевые осадки содержат, % Ті 6-8; V 4-6; CI ~45, остальное - кислород и примеси других элементов. Разработаны схемы извлечения из осадков ванадия и меди.
Вследствие высокой стоимости медного порошка стали применять для восстановления VOCl3 порошок алюминия. Последний реагирует с TiCl4 с образованием ТіС13, который затем восстанавливает VOCl3:
З TiCl4 + Al = 3 ТіС13 + АІСІ3; (4.17)
ТіСІ3 + VOCl3 = VOCl2 + TiCl4. (4.18)
Кроме того, протекает реакция:
ТіОС12 + АІС13 = AlOClJ + ТіС14. (4.19)
Осадок, содержащий VOCl2, ТіСІ3, АІСІ3, направляется на извлечение ванадия. На некоторых зарубежных заводах для очистки от ванадия применяют восстановление сероводородом или органическими веществами (углеводороды, жирные кислоты и др.).
Очистка ректификацией. Очистку хлорида титана ректификацией проводят в колоннах из нержаве-
Технический Ті С I,,
Дистиллят: sici4 и др.
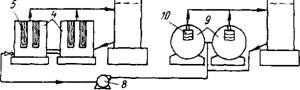
Ржс.44. Схема установки для очистки тетрахлорида титана ректификацией: 1- напорный бак с TiCt4; 2 - подогреватель; 3 - ректификационная колонна для отделения низкокипящих хлоридов; 4 - кубы-испарители с электронагревателями 5 (в патроне); 6 - дефлегматоры; 7 - регулирующий клапан; 8 - насос; 9 - кубы-испарители с открытыми нагревателями; 10,11 - ректификационная колонна для дистилляции TiCl4; 12 - распределительный клапан; 13 - сборник очищенного ТІС1.
Ющей стали с дырчатыми тарелками (или тарелками с щелеви- дными прорезями) в две стадии (рис. 44). На первой стадии отделяют тетрахлорид титана от примеси кремния (температура кипения SiCl4 58 °С) и других летучих примесей (CCl4, CS2, SOCl2 и др.), поддерживая в верхней части колонны температуру паров 132-135 С и избыточное давление
0,66-4 кПа. Температура в кубе колонны 140-150 С.
Неконденсируемые газы (С02, Cl2, N2, COCl2) выводят из дефлегматора через гидрозатвор в систему очистки газов.
Кубовый остаток, содержащий TiCl4 и примеси высококи - пящих хлоридов и оксихлоридов (в частности, TiOCl2), поступает во вторую колонну, в верхней части которой поддерживают температуру 134-136 °С (точка кипения ТіСІ4), в нижней - 137-138 С. Отбираемый дистиллят - чистый четы - реххлористый титан. Примеси высококипящих хлоридов (TiOCl2, FeCl3, AlCl3, NbCl5 и др.) остаются в кубовом остатке.
Очищенный тетрахлорид титана содержит примеси в количествах, близких к пределу чувствительности спектрального анализа (Ю-3—Ю-5 %). Извлечение титана из технического в очищенный тетрахлорид титана равно ~96%.
Производство диоксида титана
Сернокислотный способ
Основное количество выпускаемого диоксида титана из ильменитового концентрата (или титановых шлаков) получают сернокислотным способом, который включает следующие стадии:
Разложение концентрата серной кислотой;
Очистку растворов от железа;
Гидролитическое выделение метатитановой кислоты из сернокислотного раствора;
Прокаливание осадка с получением диоксида титана.
Этот способ обеспечивает высокое извлечение титана в
Готовый продукт, причем в технологии практически используют один реагент - серную кислоту.
Разложение концентрата. Разложение ведут концентрированной H2S04 (92-94 %) или олеумом в стальных реакторах. Вследствие экзотермичности процесса после нагревания кислоты с измельченным концентратом до 125-135 °С реакция проходит интенсивно с саморазогревом до 180-200°С и заканчивается за 5-10 мин. Получающаяся полусухая масса ("плав") содержит оксосульфат титана (IV) (Ti0S04 ■ Н20), FeS04, избыточную H2S04. Плав выщелачивают водой.
Очистка растворов от железа. Растворы содержат 110-120 г/л ТЮ2 (в составе Ti0S04), сульфаты железа FeS04 и Fe2(S04)3 и 200-240 г/л активной
H2so4*.
Для очистки от основной массы железа восстанавливают Fe3+ до Fe2+ железной стружкой, а затем проводят кристаллизацию железного купороса FeS04-7 Н20, охлаждая растворы
Активная H2S04 - сумма свободной кислоты и кислоты, связанной с сульфатом титана.
До -5 °С. В результате кристаллизации содержание железа в растворе понижается до ~20г/л.
Железный купорос - полезный побочный продукт, используемый в сельском хозяйстве как инсектофунгицид.
Осаждение метатитановой кислоты. Из растворов, содержащих оксосульфат титана, гидролитическим разложением выделяют метатитановую кислоту (гидратированный диоксид титана):
TiOSO, + 2 Н20 = Ti02H20 + H2S04. (4.20)
Следует учитывать, что в действительности продукт гидролиза переменного состава, содержит, кроме Ті02 и Н20, значительные количества S03.
Испаользуют два способа проведения гидролиза: способ введения зародышей и способ разбавления.
При способе введения зародышей в раствор добавляют отдельно приготовленные зародыши в форме коллоидного раствора гидроксида титана в количестве ~1 % от содержания ТЮ2. После нагревания до кипения в осадок выпадает 95-96% Ті02.
В случае применения способа разбавления исходные растворы концентрируют выпариванием до содержания 240 - 260 г/л Ті02 и затем нагретый раствор по определенному режиму разбавляют, вливая в воду. При разбавлении раствора возникают зародыши - центры кристаллизации, а затем образуется осадок метатитановой кислоты.
Прокаливание метатитановой кислоты. Отфильтрованные и промытые осадки метатитановой кислоты прокаливают в барабанных печах, футерованных высокоглиноземистым кирпичом, при максимальной температуре 850-1000 °С (в зависимости от назначения Ті02). Помимо воды при прокаливании удаляется содержащийся в осадках S03.
Способ "сжигания" тетрахлорида титана
В последние годы получает все большее развитие производство диоксида титана из тетрахлорида титана методом "сжигания", который основан на реакции:
ТіС14 + 02 = Ті02 + 2 Cl2,
AG°100 к = -81,5 кДж. , (4.21)
Эта реакция при 900-1000 °С протекает с достаточной скоростью. Получаемый хлор возвращают на хлорирование титанового сырья.
Известно несколько вариантов проведения процесса "сжигания". Рассмотрим два из них.
Реакцию проводят в камере, в которой установлена форсунка, куда поступают кислород и пары тетрахлорида титана, предварительно нагретые до 1000-1100 °С. На выходе из форсунки пары ТіС14 реагируют с кислородом с образованием желто-зеленого пламени. Поток газа уносит частицы диоксида титана в пылевую камеру и рукавные фильтры. Отходящие газы, содержащие 80-85 % хлора, пригодны для использования в производстве ТіС14.
Основное затруднение при использовании способа состоит в необходимости предварительного нагрева реагирующих компонентов до 1000-1100 °С.
Применение плазмы в качестве источника тепла - наиболее перспективный метод. Целесообразно использовать высокочастотную плазменную горелку с факелом кислородной плазмы. В факел, имеющий температуру 6000-10000 С, вводят пары тетрахлорида титана, которые при столь высокой температуре быстро реагируют с кислородом с образованием тонкодисперсного диоксида титана рутильной модификации.
Основные преимущества технологии получения диоксида титана из тетрахлорида титана по способу "сжигания" в сравнении с сернокислотным способом:
А) технологическая схема проще, капитальные затраты в среднем в 1,5 раза ниже;
Б) схема замкнута (хлор утилизируется), тогда как в сернокислотной схеме затруднительна утилизация гидролизной серной кислоты;
В) диоксид титана более высокой чистоты, а качество получаемого из него пигмента выше, чем получаемого сернокислотным способом.