МЕТОДЫ РАЗДЕЛЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
Вследствие близости свойств лантаноидов их разделе - ние - сложная задача. Применявшиеся ранее способы разделения были основаны главным образом на различии в растворимости соединений лантаноидов. В результате большого числа дробных кристаллизаций или дробных осаждений (иногда достигавших нескольких тысяч) получали отдельные элементы большей или меньшей степени чистоты. Для отделения некоторых элементов использовали способность их окислять- ся до четырехвалентного состояния (Се, Pr, Tb) или восстанавливаться до валентности 2+ (Sm, Eu, Yb). В этом случае разделение облегчается благодаря значительным отличиям в свойствах соединений лантаноидов со степенью окисления +4 и +2 и соединений лантаноидов со степенью окисления+3.
Современные схемы разделения лантаноидов основаны на использовании более эффективных методов: жидкостной экстракции и ионного обмена. Старые "классические" методы дробного осаждения и кристаллизации практически не используют в настоящее время.
Методы избирательного окисления и восстановления применяют в некоторых схемах разделения.
Избирательное окисление
Окисление церия до четырехвалентного состояния применяют для отделения его от других лантаноидов. Церий легко окисляется кислородом в процессе сушки смеси гидроксидов РЗЭ на воздухе при 120 - 130 °С или при пропускании воздуха через нагретую суспензию гидроксидов. Применяют также другие окислители: хлор, пероксид водорода. После окисления Се3+ до Се4+ гидроксиды трехвалентных лантаноидов растворяют в разбавленной (5 - 10 %-ной) азотной или соляной кислоте, в то время как гидроксид четырехвалентого церия (Се02 • яН20) остается в осадке. Последний содержит 94 - 96% Се02.
Для получения более чистого продукта используют избирательную экстракцию Ce(N03)4 из 6 - 8 н. раствора азотной кислоты трибутилфосфатом или другими экстрагентами.
Избирательное восстановление
Восстановление до степени окисления +2 применяют для отделения самария, европия и иттербия из обогащенных ими фракций. Ионы Sm2+, Eu2+, Yb2+ проявляют сходство с ионами стронция и бария. Так, их сульфаты мало растворимы в отличие от сульфатов лантаноидов (+3). В качестве восстановителей используют цинк, амальгаму цинка, амальгаму натрия.
Окислительно-восстановительные потенциалы Sm, Eu и Yb (по отношению к водородному электроду) приведены ниже, В:
Sm37Sm2+ -1,72; Yb3+/Yb2+ -1,15; Eu3+/Eu2+ -0,43;
Zn2+/Zn -0,76; Na+/Na(Hg) -1,86.
Из приведенных значений потенциалов следует, что ионы Еи3+ можно избирательно восстановить до Еи2+ цинковой пылью, не восстанавливающей ионы Sm3+ или Yb3+. Восстановление ведут в солянокислом растворе. При последующем добавлении в раствор серной кислоты осаждается малорастворимый EuS04.
Совместное восстановление трехзарядных ионов европия и самария возможно амальгамой натрия, с которой перемешивают уксуснокислый раствор, содежащий разделяемую смесь лантаноидов:
L«(CH3COO)3 + 3Na(Hg) = Zn(Hg)+ 3CH3COONa. (11.4)
Восстановленные элементы извлекают из амальгамы обработкой ее соляной кислотой. Последующее разделение европия и самария можно затем осуществить восстановлением европия цинковой пылью.
Эффективный вариант отделения европия от других РЗЭ состоит в избирательной экстракции трехзарядных ионов РЗЭ катионообменным экстрагентом - ди-2-этилгексилфосфорной кислотой (Д2ЭГФК), практически не экстрагирующей ионы Еи2+
Разделение РЗЭ экстракцией
В настоящее время экстракционные методы стали основными в схемах разделения РЗЭ. В промышленной практике для разделения преимущественно используют фосфорорганические экстрагенты - ТБФ, Д2ЭГФК и карбоновые кислоты. Разделение основано на закономерном изменении значений коэффициентов распределения в ряду лантаноидов.
Ниже экстракционное разделение РЗЭ рассмотрено на примере использования наиболее распространенного экстрагента - ТБФ. Характеристика ТБФ как экстрагента дана в гл. 2. В промышленной практике разделение РЗЭ экстракцией ТБФ большей частью осуществляют из азотнокислых растворов,
содержащих нитраты РЗЭ. Экстракция протекает с образованием трисолъвата:
^л(водн) + 3N03(BoaH) + ЗТБФ(0РГ) <—-
L/i(N03)3 • ЗТБФ(0РГ); (ц.5)
D = ^C[N03]^H) • [ТБФ](ОРГ),
Где Кс - константа равновесия реакции экстракции.
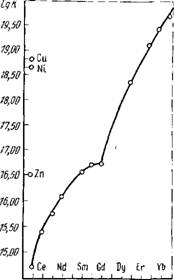
Значение коэффициента распределения в сисмете ТБФ - HN03 при высоких концентрациях HN03 (11 - 15м/л) непрерывно возрастают с увеличением атомного номера лантаноида. Однако в растворах с концентрацией HN03 ниже 5м/л происходит инверсия (обращение) закономерности изменения коэффициентов распределения для ряда европий - лютеций (рис. 82). Это объясняется проявляющимся при низкой кис - jj
Лотности возрастанием энергии гидратации в ряду тяжелых РЗЭ, что затрудняет вытеснение молекул воды из гидратной оболочки иона молекулами ТБФ. ft0
І
10~2
Ржс.82. Зависимость коэффициента распре - jq-3 деления (£>) РЗЭ от порядкового номера t
11,66М /
С
0,266 МНМ3
/J
Очі
J I I I I L
>7 59 61 63 65 67 69 71
При экстракции ТБФ
Порядковый номер
При высокой кислотности (более 12 м/л) средняя величина коэффициента разделения для соседних элементов от лантана до тербия 0 = Dz+1/Dz = 1,9; для элементов от тербия до лютеция эта величина ниже. Поэтому для всей группы РЗЭ можно принять 0 = 1,5. Для легких РЗЭ (La, Ce(IIl), Рг, Nd, Pm) кэффициенты распределения мало изменяются при увеличении концентрации их в растворах от 5 - 10 до 70 - 100 г/л: для средних P33(Sm, Eu, Gd) и тяжелых элементов
(иттриевая группа) коэффициенты распределения существенно зависят от концентрации РЗЭ в водной фазе.
РЗЭ хорошо экстрагируется ТБФ также из слабокислых нитратных растворов в присутствии высаливателей - нитратов алюминия, натрия, кальция, лития.
При использовании экстракции ТБФ для разделения РЗЭ на подгруппы процесс ведут из нитратных растворов с концентрацией HN03 7 - Юм/л. При этом иттрий попадает в подгруппу тяжелых РЗЭ (Dy - Lu).
Помимо нитратных растворов для разделения РЗЭ экстракцией ТБФ используют роданидно-хлоридные растворы. В них РЗЭ присутствуют в составе комплексов Ln(SCN)3 и Ln(SCN)2Cl, устойчивость которых повышается от лантана к лютецию. Экстрагируемый комплекс имеет состав Ln(SCN)3 ■ • «ТБФ, п = 3-И.
В практике разделения РЗЭ экстракций процесс большей частью проводят в каскаде экстракторов типа смеситель - отстойник. Используют систему полного противотока, которая состоит из экстракционной и промывочной секций и секции реэкстаракции (см. рис. 83). Общее число ступеней каскада 50 - 90.
Исходный раствор, содежащий разделяемую смесь, поступает в среднюю часть каскада. Очевидно, что для разделения п элементов смеси потребуется проведение п - 1 последовательных операций или п - 1 экстракционных каскадов.
Первоначально в режиме полного противотока проводят
Исходный раствор РЗМ (А* в)
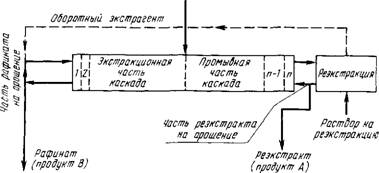
Р«с.83. Схема разделения РЗЭ экстракцией в системе полного противотока
Разделение РЗЭ на подгруппы: легкие РЗЭ (La, Се, Pr, Nd), средние (Sin, Eu, Gd, Tb) и тяжелые (Dy - Lu + Y). Затем ведут дальнейшее разделение в каждой из подгрупп.
Соответственно этому расчет первого каскада проводят, ориентируясь на разделение неодима и самария (используя для расчета значение Psm/Nd)> ПРИ расчете второго каскада ориентируются на разделение по линии тербий - диспрозий (используют значение Рру/тъ)-
При групповом разделении промывным раствором большей частью служит азотная кислота.
В других вариантах разделения РЗЭ, в частности разделении бинарных смесей (А + В), например неодима и самария, используют каскад с обменной промывкой. В этом случае в промывной каскад возвращают часть экстракта, содержащего лучше экстрагируемый компонент, например В. При этом в промывочном каскаде в результате контакта фаз компонент В вытесняет из органической фазы примесь компонента А. Это способствует получению более чистого компонента В, уменьшаются относительные расходы промывочного раствора и экстрагента.
Разделение РЗЭ методом ионообменной хроматографии
Как указано выше, в настоящее время жидкостная экстракция - основной способ разделения РЗЭ. Ионообменная хроматография - дополнительный метод, используемый для получения индивидуальных РЗМ высокой степени чистоты, преимущественно тяжелых.
Для разделения лантаноидов методом ионообменной хроматографии применяют различные типы катионитовых смол (в СССР катионит марки КУ-2). Они представляют собой сильно кислотные катиониты, получаемые совместной полимеризацией стирола и дивинилбензола и содержат активные группы - S03H. Разделение осуществляют большей частью методом элю - ентной хроматографии.
Сродство ионов лантаноидов к смоле убывает от La3+ к Lu3+, т. е. в порядке уменьшения размера гидра тированных ионов. Однако сродство к смоле ионов РЗЭ очень близко, что не обеспечивает достаточно эффективного разделения. Лучшее разделение достигается при использовании элюирую - щих растворов, содержащих органические соединения, образующие с ионами РЗЭ комплексы различной устойчивости.
Вымывание происходит в последовательности, соответствующей прочности анионных комплексов лантаноидов. По мере движения вымывающего раствора вдоль колонки (или ряда последовательно соединенных колонок) смесь катионов разделяется на отдельные сорбционные зоны (полосы), перемещающиеся с определенной скоростью к выходу колонки. Для вымывания применяют различные органические соединения, образующие комплексы с лантаноидами: лимонную кислоту, нит- рилотриуксусную кислоту (НТА) и этилендиаминтетрауксусную кислоту (ЭДТА). Последнюю наиболее широко применяют при хроматографическом разделении РЗЭ. ЭДТА относится к классу а-аминокислот. Она представляет собой четырехосновную кислоту с двумя атомами азота:
НООС - СНА /CHj - соон
N - CHj - СН2 - N НООС - сн/ ЧСНг - СООН.
Сокращенно формулу ЭДТА обозначают H4V. Двунатриевая соль этой кислоты имеет техническое название "трилон-Б".
С трехзарядными ионами лантаноидов ЭДТА образует внут - рикомплексные соединения (хелаты), в которых атомы азота связаны с ионом лантаноида координационными связями
СН2СООН N — СН2СОО -
СН2 ^
I >Ln3+
СН2 ^
N — СН2СОО - СН2СОО-
Константу устойчивости этих комплексных соединений определяют из уравнения:
Ln3+ + HV3- z± H(Lnv); (11.9)
К = [на«у)і
[Ln 3 + ] • [HV3-] Как видно из рис. 84, константы устойчивости у комплексов лантаноидов с ЭДТА увеличиваются от лантана к лютецию, т. е. с возрастанием порядкового номера элемента. Константы устойчивости комплексов двух соседних РЗЭ отличаются одна от другой в среднем в 2,4 раза. Это обусловливает большую избирательность действия этилендиаминтет - рауксусной кислоты при ее применении для элюирования катионов РЗЭ со смолы.
РЗЭ разделяют в системе, состоящей из ряда последовательно соединенных колонок, заполненных смолой. Первые одна или две колонки служат для насыщения смолы катионами РЗЭ, последующие колонки - разделительные. В процессе элюирования в них образуются сорбционные полосы.
La Pr Pm Eu ТЬ Элементы
Tm Lu
Рис.84. Зависимость констант устойчивости К комплексов РЗЭ с ЭДТА от порядкового номера элемента
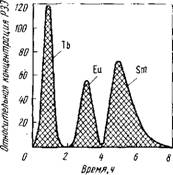
Pmc.8S. Кривые вымывания тербия, европия и самария, сорбированных на смоле, 0,26 М раствором ЭДТА; рН = 3,62
В колонках для насыщения смолу сначала заряжают ионами NH+ (т. е. применяют смолу в NHj-форме). В разделительных колонках применяют смолу в Си2+-форме. Ионы Си2+ играют в этом случае роль иона-замедлителя, способствующего лучшему разделению. Ионы меди образуют с ЭДТА более прочные комплексы, чем большинство ионов лантаноидов (см. рис. 84). Поэтому при прохождении вымывающего раствора, содержащего комплексные ионы РЗЭ с ЭДТА, через разделительную колонку ионы меди переходят в раствор, вытесняя ионы РЗЭ из раствора в смолу и этим замедляя их продвижение. Это обеспечивает высокую концентрацию ионов РЗЭ в смоле.
Обычно работают с вымывающим раствором (элюатом), значение рН которого доводят до 3,5 - 8,5 (низкие рН при разделении легких РЗЭ, более высокие - для тяжелых РЗЭ) нейтрализацией гидроксидом аммония. Следовательно, элюант содержит аммонийную соль ЭДТА. Так как аммонийные соли комплексных кислот лантаноидов с ЭДТА и медные комплексы сравнительно малорастворимы, для элюации применяют растворы ЭДТА малой концентрации (5 - 10 г/л). При больших концентрациях выделяются соли, забивающие поры между зернами смолы, что приводит к нарушению нормальной работы. Малая концентрация ЭДТА в элюанте ограничивает производительность процесса разделения, так как в фильтрате, вытекающем из колонки, низкая концентрация РЗЭ.
На выходе из системы колонок фильтрат собирают отдельными фракциями. На рис. 85 показаны кривые вымывания раствором ЭДТА для случая разделения трех элементов. Первая волна соответствует выходу тербия, вторая - европия, третья - самария, что согласуется с убывающей прочностью комплексных соединений в ряду Tb - Eu - Sm.
Для регенерации ЭДТА растворы подкисляют до рН = 0,5 * 1. При этом комплексные соединения лантаноидов разрушаются и осаждается малорастворимая ЭДТА.
Если начальная удельная загрузка (отношение массы сорбированной на смоле смеси разделяемых ионов к общей массе смолы) небольшая (ниже 5 % массы смолы), а общая длина колонок для разделения достаточно велика, то выходящие из колонки фракции фильтрата содержат только один из разделяемых лантаноидов.
Общие схемы полного разделения
Применяют различные схемы полного разделения РЗЭ, в которых сочетаются описанные методы. В качестве примера на рис. 86 приведена схема разделения элементов дериевой группы. На разделение обычно поступает смесь гидроксидов, очищенная от примесей других элементов. Первоначально из смеси может быть выделен церий методом окисления. Затем производят разделение методом противоточной экстракции на три фракции: легкие РЗЭ (La, Се, Pr, Nd), средние РЗЭ (Pr, Nd, Sm, Eu) и фракцию, обогащенную гадолинием и элементами иттриевой группы (Nd, Sm, Eu, Gd+Yb). Из второй и третьей фракций можно выделить самарий и европий восстановлением амальгамой натрия и разделить их, как описано выше. Разделение элементов в каждой из выделенных фракций проводят, используя методы экстракции и ионообменной хроматографии.
При разделении элементов иттриевой подгруппы методом экстракции выделяют иттрий (например, используя экстракцию в хлоридно-роданидной системе) и две фракции: Gd, Tb, Dy, и Но, Er, Tu, Tb, Lu. Дальнейшее разделение ведут с
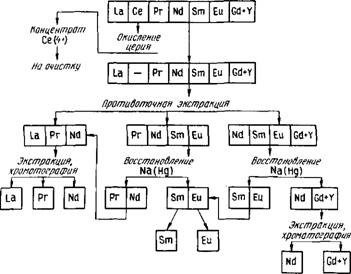
Ркс.86. Принципиальная схема разделения РЗЭ цериевой группы
Использованием экстракции (методы полного противотока или полупротивотока) и ионообменной хроматографии. Иттербий выделяют восстановлением из нитратных растворов амальгамой натрия.