МОДЕЛЬНАЯ ТЕОРИЯ АКТИВНОГО ИОННОГО ТРАНСПОРТА
Поддержание постоянной разности электрохимических потенциалов между цитоплазмой и внешней средой требует активного транспорта ионов в направлении, противоположном направлению падения потенциала. Неравновесная термодинамика такого процесса изложена ранее.
Активный поток Na+ из клетки зависит от внутриклеточной концентрации натрия с1Ыа [38, 39] и внеклеточной концентрации калия с« [39, 40]. Кривые JNa(c'Na) и /к(с£) имеют S-образную форму. Эти факты, а также ряд других требуют объяснения.
Как уже сказано, источником свободной энергии для поддержания активного транспорта является АТФ (см. стр. 119). АТФ усиливает активный транспорт, будучи введена внутрь клетки, но не влияет на него, находясь во внешней среде [41]. Из клеточных мембран удалось выделить К, Na-эктивируемую АТФ - азу [42]. Этот фермент расщепляет АТФ только в присутствии К+ и Na+. Действие АТФ в мембране непосредственно связано с активным транспортом — глюкозид оубаин ингибирует АТФ - азу при той же концентрации, при которой он прекращает работу натриевого насоса. Гидролиз АТФ in vitro с помощью этой АТФ-азы происходит в две стадии [43]. Вначале выделяется АДФ, а неорганический фосфат остается связанным с ферментом. Эта стадия активируется ионами Na+. Второй этап требует присутствия К+ и состоит в отщеплении фосфата от фермента. Сходная, но уже пространственная асимметрия свойственна насосу— на внутренней поверхности мембраны его активность зависит от на внешней — от [44]. При расщеплении АТФ на мембранах наблюдается переход меченого фосфора из АТФ в фосфопротеиды мембраны [45, 46]. Кинетика действия АТФ - азы in vitro характеризуется S-образной зависимостью скорости реакции от концентраций Na+, К+ и АТФ [47]. Гидролиз одной молекулы АТФ в мембране сопровождается выходом из клетки двух — трех ионов Na+ [48].
Для согласования всех этих фактов и их объяснения предлагались различные модели натриевого насоса. В модели Опита и Чарнока [49], основанной на структурной модели мембраны, предложенной Даниэлли и Давсоном (см. далее, стр. 137), белок мембраны, расположенный на ее внутренней поверхности, приобретает АТФ-азную активность под действием Na+ и фос - форилируется при расщеплении АТФ:
Na+ • АТФ + Е Na+ • Е • Ф + АДФ.
В результате фосфорилирования происходит резкое конформа- ционное превращение белка, поворот макромолекулы, выносящий занятые Na+ ионообменные центры к внешней поверхности мембраны, причем Na+ заменяется на К+:
Na+ • Е • Ф + К+ К+ • Е • Ф + Na+.
Комплекс фосфопротеида с К+ гидролизуется, отщепляется фосфат и молекула белка возвращается в исходное состояние:
К+ • Е • Ф Е + Ф + К+.
Обратный конформационный переход, обратный поворот молекулы вносит ионы внутрь мембраны. Оубаин ингибирует именно последнюю стадию. Таким образом, в этой модели АТФ-аза рассматривается как конформационный переносчик. Модель является качественной и не подкреплена расчетами. Ее достоинство состоит в том, что она учитывает сочетание ферментативной
В* реакции с ионообменной и кооперативный характер процесса. Но предложенный механизм представляется искусственным, так как он требует перемещения больших участков макромолекулы от одной поверхности мембраны к другой. Экспериментальные подтверждения такого перемещения отсутствуют. В работе [50] количественно проанализирована модель с участием переносчика, который может находиться в нескольких формах. Теория эта исходит из частных предположений и вводит в'расчет 19 независимых параметров. Поэтому ее нельзя проверить экспериментально. В работе [51] рассмотрена модель с двумя переносчиками, в работе [52] — модель функционирования активного центра К, Na-активируемой АТФ-азы. Были получены некоторые сведения об этом ферменте. По-видимому, он представляет собой тетрамерный белок с молекулярным весом около 250 ООО и содержит два типа субъединиц аир (молекулярные-веса 84000 и 57 000) по две каждого сорта. Лишь субъединицы а присоединяют фосфорную метку из меченой АТФ [53, 54]. Исходя из этого, Штейн и соавторы предложили конкретную модель активного транспорта, определяемого информационными превращениями АТФ-азы [55]. Переход из одной конформации в другую вызывает изменения сродства к катионам соответствующих активных центров. В одной конформации а-субъединица связывает Na+ и р-субъединица связывает К+, в другой — наоборот. Конформационное превращение сопровождается гидролизом АТФ, отщепленный фосфат первоначально присоединяется к а - субъединице. В работе [52] аргументируется участие трех аминокислотных остатков в этом процессе: Глу, Гис и Сер.
Рассмотрим подробнее кинетическую модель, предложенную в работе [56]. Предполагается, что имеются два типа активных центров, способных присоединять и обменивать Na+ и К+. Первый тип центров неспецифичен, эти центры участвуют в пассивном транспорте (см. § 3.5). Центры второго типа принадлежат АТФ-азе и обеспечивают активный транспорт. Перемещение ионов происходит по эстафетному механизму.
Фермент катализирует гидролиз АТФ. Обозначим АТФ буквой X, АДФ (или АМФ) — Z и фосфат — Ф. Связь ионообменной реакции с ферментативной запишем в виде
Na' + Ег • К + X А Ег • Na • Ф + Z + Кг. ъ-\
Индекс і по-прежнему относится к внутренней стороне мембраны, е — к внешней. На внешней стороне
Ке + Ее • Na • Ф & Ее • К + Ф + Na®.
— 2
Комплекс Na-Ф, распадающийся на внешней стороне мембраны, перемещается к ней от места своего образования по градиенту
концентрации. Если сродство обменных центров к ионам велико и свободные центры отсутствуют, то перемещение комплекса Na • Ф и обмен на К можно представить в виде обменной реакции
Е' • Na • Ф + Е® • К ^ Е' • К + Е® • Na. ф.
К-3
Таким образом, обобщенная сила, перемещающая ионы, — разность химических потенциалов продукта Z, которая поддерживается ферментативной реакцией.
Предположим далее, что обмен на ферментных центрах и ферментативная реакция происходят кооперативно. Иными словами, центры взаимодействуют друг с другом таким образом, что обмен лиганда происходит практически одновременно на нескольких центрах. Такой кооперативный обмен наблюдается, например, в цеолитах [57], где он определяется изменением структуры решетки вследствие обмена ионов. Соответственно введем в уравнения реакций стехиометрические коэффициенты, не равные 1. Общая схема реакций имеет вид
ANa' + E'-Kg + YX Ег • Naa • Yv + РК' + yZ
'N. Jf *-3Jf*3 *з|*-з f'K
A Na® + E® • KB + VY E® • Naa • Yv + PK®.
— 2
Здесь /Na и /к — пассивные потоки, а, р, y — стехиометрические коэффициенты. Сопряжение направленных потоков изображено на рис. 3.6. Кинетические уравнения написанных реакций имеют вид
Т = - Ка)° Ы* 4 + А-І (4)Є (<*)' 4а. Т fiNa = — К.)в (Cx)V 4 + A-I (4)6 ЫЧа + /N.; "s"<5Na== Піі& ' ^-2(CNa) (Cy)V 4 ' ^Na> (3.122)
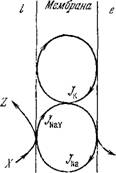
Рис. 3.6. Сопряжение ионных потоков в мембране с химической реакцией (Y—фосфат).
Tdk = k 1 (4аГ (^x)V 4-^-1 (4)0 (Cz)V 4a + 4 ^= - kX (CNa)a (<x)V 4 + (4)P Ы 4a +
Где cljt с* — безразмерные концентрации, т. е. молярные концентрации иона сорта j внутри и вне клетки, отнесенные к молярным концентрациям воды в соответствующих объемах сн, о> сн2о"> п/> — числа занятых ионами обменных мест фермента на единицу площади внутренней и внешней поверхности мембраны, S — площадь мембраны. Одновременно
4 + Пк = П'> ПК + ttNa = п" (3-123)
И
Snk + SnK + сн2оск + сн2оск ~ пк> | ^ ^
Соотношения (3.123) и (3.124) выражают сохранение числа обменных центров на поверхностях мембраны и полного числа ионов каждого сорта.
В стационарном состоянии правые части (3.122) равны нулю. В клетке расходуется только вещество X (АТФ).
Из двух первых уравнений (3.122) следует, что активный выход Na+ из клетки определяется скоростью реакции сх и в стационарном состоянии компенсируется пассивным потоком
Считая ферментативные реакции необратимыми, положим k-i = k-2 — k-3 = 0. В этом приближении активный поток Na+ из клетки равен
1 = К Ка)° (<x)V < = К (Ск)Р ^ ShnLnb (3-125)
Считая концентрации ионов Na+ и К+ в растворах независимыми друг от друга, получаем отсюда
СГ = Г /(/.-/)-IV r3.2fiv
См- +*,(*?) J°°-J J ' ( }
Т. е. Сца выражена как функция потока J при заданных с®, сх. Здесь
'о = Vе Kf> = K)7(s Vі + К Kf)-
Анализ (3.126) показывает, что кривая c^a(f) имеет один перегиб в интервале 0 < / < /«=, что согласуется с опытом [56]. То же относится и к с|(7). Если а = р= 1, т. е. отсутствует кооперативное взаимодействие между активными центрами фермента, то перегиба нет. В этом смысле АТФ-азная реакция подобна другим ферментативным процессам.
Описанная кинетическая модель согласуется с опытом и показывает, что специфическая роль белка-фермента в мембранном транспорте состоит в сопряжении транспорта с метаболизмом.
Мы не обсуждали пока конкретные пути переноса ионов через мембраны. Законно поставить вопрос о реализации переноса через поры, каналы в мембране или посредством специальных переносчиков [58]. Ходжкин впервые выдвинул предположение о «натриевых» и «калиевых каналах» [59]. Очевидно, что последовательность соответствующих ионообменных центров также может трактоваться как канал. Однако существование каналов доказывается и непосредственно (см. [58, 183, 184]).
Оказалось, что клеточные мембраны проницаемы не только для воды и ионов, но и для ряда нейтральных молекул, растворимых в воде, но не растворимых в липидах (см., например, [60]). В возбудимых мембранах (см. гл. 4) существуют специализированные ионные поры, проницаемость которых зависит от природы ионов [61]. Селективность каналов велика, но не абсолютна. Так, отношения проницаемостей Рщт/Рпа для натриевых каналов перехвата Ранвье (см. стр. 161) для гидроксиламина 0,94, для Li+ 0,93, для NHJ 0,16, для К+ 0,09. Для калиевых каналов P„0,i/PK для Т1+ 2,3, Rb+ 0,91, NH4+ 0,13, Cs+ 0,08, Na+ 0,01 [62] (дальнейшие подробности см. в [58]). Блокирование каналов другими ионами позволяет получить информацию о функциональной «архитектуре» каналов.
В работе [63] предложена теоретическая модель канала в двойном слое липидов (см. стр. 137). Предполагается, что на стенках канала имеются кооперативно действующие активные центры. Переносимый ион подвергается действию силового поля и свободно движется вдоль канала. Движущиеся ионы могут трактоваться как ионный газ.
Прямое доказательство наличия каналов состоит в том, что в отсутствие проникающих ионов Na+ и К+ высокочастотная проводимость мембраны равна нулю. Если бы в ней функционировали подвижные заряженные группы, то должен был бы наблюдаться электрический ток. Удается оценить количественные характеристики каналов, число которых, приходящееся на 1 мкм2 мембраны, составляет несколько сот. Так, проводимость одиночного натриевого канала 4-Ю-12 Ом-', калиевого — 12-Ю-12 Ом-1 [185]. Сечение Ыа+-канала — примерно З X 5 А2, пропускная способность—107 ион/с. Ионный канал можно трактовать как своего рода «векторный фермент», катализирующий перенос иона. Активность этого «фермента», несомненно способного к конформационным перестройкам, регулируется электрическим полем [184].
В серии работ [186] проведено сопоставление перескокового и электродиффузионного механизмов движения частиц в тонких мембранах.
Проблемы активного транспорта, описанные здесь, имеют непосредственное отношение к возбудимым мембранам. Рассмотрение свойств этих мембран в связи с генерацией нервного импульса приведено в гл. 4.