КОНФОРМАЦИОННЫЕ СВОЙСТВА МЕМБРАН
До сих пор мы говорили о статическом строении мембран и не рассматривали их динамические свойства, их фазовое состояние.
Ряд фактов свидетельствует о большой лабильности мембранной структуры [75, 89—92]. Липиды мембраны обладают высокой подвижностью и должны рассматриваться как жидкие кристаллы. Еще в 1933 г. Бернал писал, что свойства жидких кристаллов «как раз те свойства, которые требуются на уровне организации, промежуточном между непрерывным веществом, жидким или твердым, кристаллическим веществом и простейшей живой клеткой» [93]. В жидком кристалле реализуется сочетание текучести и лабильности при наличии преимущественной ориентации.
Жидко-кристаллические (жидкостные) свойства мембран определяются тем, что липиды в них находятся при физиологической температуре в расплавленном состоянии. Как мы увидим, расплавлены углеводородные цепи. Температура плавления углеводорода тем ниже, чем больше двойных связей он содержит при прочих равных условиях (вспомним различие между животным и растительным маслом). Липиды, содержащие в углеводородных цепях ненасыщенные двойные связи, плавятся при температурах ниже физиологических. В плазматических мембранах млекопитающих доля таких липидов велика.
Жидкостные свойства мембран доказываются многими фактами. Установлено, что в некоторых клетках поверхностные антигены свободно диффундируют в мембране. Подвижность мембранной структуры обнаруживается с помощью парамагнитных [94] и флуоресцентных меток [95, 96], а также методом ЯМР - спектроскопии [97]. На рис. 3.8 показаны результаты исследова
ния подвижности мембран методом электронной спин-резонанс - ной спектроскопии. Нитроксильная спиновая метка присоединяется к хвосту липидной молекулы, которая вводится в двойной липидный слой мембраны.
CHg CHg СН 2 СН2 СНг CHg СН^ CHg н„с С
О а и • и о
НО^-с
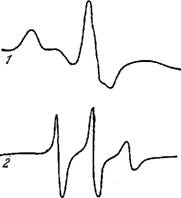
Рис. 3.8. Спектры ЭПР спин-меченой молекулы липида, помещенной в мембрану.
1 — низкая температура, 2—высокая температура.
II о
Спектр ЭПР при низкой температуре показывает, что липид заморожен, при высокой он оказывается расплавленным и спектр становится острее (см. [68]).
Как писал Брайтон (см. [80]): «Мы начинаем представлять себе море липидов, в котором плавают другие молекулы. Мы узнаем большую подвижность компонентов мембраны, испытывающих непрерывную реорганизацию». Наибольшей подвижностью как конформационной, так и трансляционной обладают углеводородные «хвосты» липид - ных молекул в матриксе мембраны [89, 98].
В 1973 г. на страницах журнала «Science» была опубликована дискуссия по вопросу о жидкостных свойствах мембран. Олдфилд в статье под заглавием «Жидки ли клеточные мембраны?» [99] привел доказательства того, что значительная часть липидов в мембранах ряда микроорганизмов (возможно, тех, в которых нет холестерина) находится в твердом гелеобразном состоянии. Синджер начал свой ответ на эту статью словами: «Да, мембраны жидкие» [100]. Он подчеркнул, что в тех случаях, о которых пишет Олдфилд, не все липиды находятся в мембране в твердом состоянии.
Особенно детально изучены жидкостные свойства фоторецеп- торных мембран (см. § 7.10). Фоторецепторные мембраны палочек содержат практически лишь один белок—- родопсин. Одна
молекула родопсина в мембране приходится на 60—90 молекул липидов, из которых 80% содержат ненасыщенную жирную кислоту [101]. Методом вспышечной фотометрии установлено, что молекула белка испытывает быстрое вращение вокруг оси, перпендикулярной к плоскости мембраны. Время такой вращательной диффузии 20 мкс при 20 °С [102]. Изучение взаимодействия родопсина со светом (выцветание, см. § 7.9) методом микро - спетрофотометрии показало, что в мембране происходит и трансляционная латеральная диффузия родопсина. Коэффициент диф-
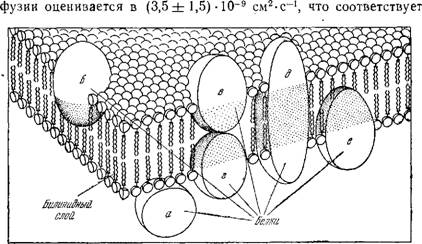
Рис. 3.9. Современная схема строения клеточной мембраны [68]. а, б, в, г, д, е — различные белковые молекулы.
Вязкости мембраны от 1 до 4 П [103]. Это согласуется по порядку величины с вязкостью, определенной по трансляционной диффузии, в мембранах клеток млекопитающих [104] и в мембранах митохондрий и нервных аксонов [105, 106]. Таким образом, вязкость мембран на два или три порядка выше вязкости воды и соответствует вязкости растительного масла.
Текучесть мембран непосредственно наблюдалась при микроскопическом изучении простейшего Cryptotermes [107].
Изложенные факты позволили построить динамическую мозаичную модель мембраны [65, 75, 91, 108—111]. Ее схематическое изображение дано на рис. 3.9 [68]. Белки «плавают в ли - пидном море». Их молекулы погружены с двух сторон мембраны и а разную глубину в двойной слой подвижных углеводородных «хвостов» липидов; имеются белки, проходящие через всю мембрану. Строение мембраны асимметрично. Значительная ч^сть поверхности мембраны свободна от белков — так, белки занимают 70% поверхности мембраны эритроцита и 80% поверхности мембраны микросомы [112]. В фоторецепторных мембранах родопсин расположен еще реже (см. выше).
Каналы (поры) в мембранах, вероятно образуются вблизи молекул белков и выстланы полярными группами [113]. Природа и строение каналов — одна из актуальных проблем физики мембран.
В мембранах, по-видимому, существуют и более жесткие кристаллические участки. В них может реализоваться дислокационная подвижность [114].
Ряд фактов свидетельствует о конформационных переходах в мембранах. Им посвящено множество работ; в частности, изучались структурные изменения, связанные с электрической активностью возбудимых мембран. Как уже указывалось на стр. 142, структурные изменения обнаруживаются при помощи флуоресцентных и парамагнитных меток [115, 116], а также при измерении двойного лучепреломления [117—119] и рассеяния света [117, 120, 121]. В работах [122—124] изменения параметров люминесценции присоединенных к мембране красителей, сопровождающие возбуждение, также рассматривались как результаты конформационных переходов (см. [96]).
Существенную информацию дают измерения кругового дихроизма (КД), свойства, особенно чувствительного к структурным перестройкам оптически активных молекул. Измерения КД и оптической активности позволяют охарактеризовать конформации белков в мембранах и их изменения (см., в частности, работу, проведенную на суспензиях мембран [125]).
Уверенная интерпретация всех этих интересных и важных данных, однако, затруднительна. Надо иметь в виду, что изменения оптических и спектральных свойств могут вызываться и просто перезарядкой мембраны — эффектами электрострикции, перемещением самих меток под действием электрического поля и т. д. [89].
Прямую информацию о конформационных свойствах мембран дает изучение наблюдаемых в них фазовых переходов, которые можно трактовать как плавление липидов. Такой переход происходит вблизи 0°С при нагревании мембран митохондрий и микросом от —40°С [126]. Переходы наблюдаются методами флуоресценции, светорассеяния, дилатометрии. Они зависят от ряда факторов — от ионной силы окружающего раствора, от рН, от природы ионов [127, 128]. С помощью спин-метки в суспензии плазматических мембран, выделенных из фибробластов мыши, найдены характеристические температуры латерального разделения фаз в липидах. Для внешнего монослоя липидов такие переходы наблюдаются при 15 и 31 °С, для внутреннего — при 21 и 37 °С ([129], см. также [89, 92]).
Подвижность мембранных липидов и фазовые переходы в них определяются их конформационными свойствами. Плавление липидов происходит путем поворотной изомеризации углеводородных цепей — это конформационное плавление [130]. В этом смысле поведение мембранных липидов соответствует общим принципам молекулярной биофизики, согласно которым важнейшие свойства биополимеров связаны с их конформационной подвижностью [131].
Насыщенные углеводороды, парафины, кристаллизуются в форме сплошных гранс-ротамеров. При плавлении наряду с гранс-ротамерами появляются свернутые, или гош-ротамеры [130]. В жидких парафинах их концентрация порядка 10%. Это должно относиться и к углеводородным «хвостам» в липидах.
Фазовые переходы в липидах изучались детально. На рис. 3.10 показаны изменения с температурой теплоемкости и энтальпии раствора дипальмитоил-а-лецитина [132]. Наблюдаются два фазовых перехода — при 34 °С и особенно резкий при 41 °С. Рентгенограмма при температуре ниже перехода содержит резкие дифракционные кольца, отвечающие расстоянию между цепями 4,8 А, при температуре выше перехода — диффузное кольцо, отвечающее расстоянию между цепями 5,3 А. В жид - ко-кристаллическом липиде времена корреляции для СН2-групп
порядка 10~6—Ю-8 с, о чем свидетельствуют данные, полученные методами ЯМР и ЭПР [133, 134].
В работе Нагле предложена модельная статистическая теория фазовых переходов в мембранных липидах [135]. В своей модели он исходит из того, что энергия системы определяется суммой энергии ротамеризации в цепи, энергии ван-дер-вааль - сова притяжения и энергии стерического отталкивания цепей. Переходы трактуются как переходы порядок — беспорядок. При расчетах предполагается, что модельные цепи располагаются на двумерной трехугольной или квадратной решетке. Воспользовавшись значениями разности энергий гош - и транс-ротамера, равной АЕ = 0,5 ккал на 1 моль связей, и параметра ван-дер - ваальсова притяжения, равного а = 5,2 ккал на 1 моль СН2-групп, Нагле получил для трехугольной модели резкий фазовый переход второго рода при 353К (опыт — 315К). При уменьшении а до 1 ккал/моль переход оказывается переходом первого рода. «Квадратная» модель дает худшие результаты. Слабый переход при 34 °С согласно [135] определяется изменением упорядоченности фосфатных «голов» липидов.
В работе Трейбле предложена теория транспорта молекул через липидную мембрану, основанная на тех же представлениях о ротамеризации углеводородных цепей [136]. Свернутые (гош) ротамеры трактуются как подвижные структурные дефекты — «кинки», определяющие наличие малых свободных объемов в углеводородной фазе мембраны. Коэффициент диффузии этих «кинков» оценивается в Ю-5 см2/с; следовательно, такая диффузия — быстрый процесс. Транспорт малых молекул происходит в результате их попадания в указанные свободные объемы и миграции вместе с ними. Эта красивая идея дает модель «кинетических каналов» в мембране и позволяет вычислить ее проницаемость для воды в согласии с опытом.
В работе Марша развита статистическая механика фосфоли- пидных двуслойных мембран, учитывающая в явной форме ро - тамеризацию и межцепные стерические ограничения [137]. Величина АЕ принимается равной 0,75 ккал/моль (в работе [136] АЕ = 0,8 ккал/моль). В разумном согласии с опытом вычислены изменения энтальпии и энтропии при плавлении двуслойного липида, являющемся фазовым переходом первого рода. Концентрация дефектов согласуется с оценкой, данной в работе [136].
В работе [182] предложена модель фазовых переходов в фос- фолипидах, учитывающая наряду с ротамеризацией и крутильные колебания (ср. также [130]).
Можно считать установленной конформационную природу жидко-кристаллических свойств мембран. Тем не менее теоретическое и экспериментальное исследование этих свойств пока лишь начато, и мы еще далеки от их полного понимания.
С указанными свойствами тесно связаны явления взаимодействия мембран с различными лигандами, имеющие большое значение для физиологии и фармакологии.
Во многих случаях реакции клеточных мембран на присоединение специфических лигандов имеют кооперативный характер. Зачастую кривые ответов мембраны и клетки на возрастающую концентрацию лиганда отклоняются от изотермы Ленгмюра и имеют небольшой изгиб [138], а в некоторых случаях перегиб оказывается и очень резким.
Так называемые колициногенные штаммы бактерий Escherichia coli продуцируют макромолекулярные антибиотики — ко - лицины, способные убивать бактерии других, «чувствительных» штаммов Е. coli. При этом число молекул колицинов, нужное для того, чтобы убить одну бактерию, может быть очень малым, оно может даже равняться единице [139]. Гибель клетки определяется изменением ряда ее биохимических функций. Тем самым, мембрану «чувствительной» клегки можно считать обладающей усилительными свойствами — рецепция одной молекулы служит триггером, вызывая макроскопические события в масштабе клетки.
По-видимому, триггерные процессы сходного типа реализуются в мембранах рецепторных клеток — при рецепции запаха и вкуса, а также при зрительной рецепции световых квантов (см. гл. 7). Предпринята успешная попытка моделировать мембранную рецепцию запаха.
Получены искусственные липидные мембраны, реагирующие на некоторые пахучие вещества (камфору, мускус, линалол, н. октиловый и н. амиловый спирты). В основу метода получения таких мембран положено изменение искусственных липидных мембран под действием компонентов соскоба обонятельной выстилки лягушки, подвергнутого ультразвуковой обработке. В присутствии ионов Na+ или Са++ мембраны реагируют на пахучие вещества увеличением проницаемости. Этот эффект блокируется двухлористой ртутью, реагирующей с SH-группами белков. Показано, что в условиях, когда ответ мембраны на одно из пахучих веществ доведен до максимального уровня, мембрана сохраняет способность реагировать на другие пахучие вещества. Молекулярный вес компонента обонятельной выстилки, способного сенсибилизировать искусственные липидные мембраны к действию пахучих веществ, превышает 100000 [140].
Установлено, что некоторые лекарственные вещества влияют на температуру конформационного плавления лецитина [141]. Взаимодействие мембраны эритроцита с лекарственными веществами исследовалось в работе [142]. Показано, что анионы внедряются во внешнюю сторону мембраны, растягивая внеш - ний монослой липидов, и деформируют таким образом клетку. Напротив, катионы (в частности, вещества, содержащие четвертичные аммониевые основания), внедряются во внутренний монослой липидов, причем деформация клетки имеет в этом случае противоположный характер.
Еще до построения динамической мозаичной модели Шанжё и его соавторы предприняли попытку объяснить кооперативное взаимодействие мембраны с лигандами. Они рассматривали мембрану как упорядоченную кооперативную систему, построенную из различных или идентичных протомеров, т. е. повторяющихся субъединиц [143, 144]. В работах Шанжё и его соавторов триггерные свойства мембраны трактуются на основе теории, аналогичной теории кооперативного поведения ферментов, предложенной Моно, Уайманом и Шанжё ([145], см. также [131], гл. 7). Каждый протомер имеет ре - цепторный центр для данного специфического лиганда, сродство к которому меняется при изменении конформации прото - мера. В упорядоченной «решетке» мембраны протомеры взаимодействуют со своими соседями, чем и определяются кооперативные свойства.
Качественные результаты естественно получаются уже в простейшем случае двух конформационных состояний идентичных протомеров. Поведение системы описывается функцией состояния и функцией связывания, отвечающих соответственно доле протомеров в одной из двух конформаций и доле центров, связавших лиганд. Энергии связывания в двух конформациях различны. Задача решается в приближении молекулярного поля (см. [131], § 1.5). Параметр кооперативности определяется взаимодействием между протомерами — предполагается, что энергия перехода между двумя конформациями линейно зависит от указанной функции состояния. Если кооперативности нет, то функция состояния и функция связывания гиперболически зависят от активности лиганда, и получаются изотермы Ленгмюра. Напротив, при наличии кооперативности эти зависимости S-об - разны и в пределе, при некотором критическом значении активности лиганда, обе функции имеют разрыв, подобный фазовому переходу всей системы от одного конформационного состояния к другому.
В зависимости от активности лиганда и энергии взаимодействия протомеров ответ мембраны на присоединение лиганда может быть постепенным или S-образным, становясь в пределе переходом типа «все или ничего».
Эти результаты, конечно, полностью соответствуют сделанным предположениям. Шанжё трактует с помощью описанной модели действие колицинов [147], механизм которого пока еще недостаточно изучен экспериментально. По-видимому, их действие связано с изменением катионной проницаемости мембран [146]. Та же модель применена к проблемам фармакологии [147]. Гипотеза Шанжё дает качественное объяснение ряду фактов, в частности, тому, что различные родственные лекарственные вещества вызывают различные максимальные ответы мембран. Можно считать установленным, что первичное действие лекарств локализовано в мембране и имеет кооперативный характер. Лекарства действуют в очень малых концентрациях (вплоть до концентраций 10-11 М) и обладают высокой химической специфичностью. По-видимому, воздействие лекарств на рецептор определяется молекулярным узнаванием (см. гл. 1); но о природе таких рецепторов известно еще очень мало (см., в частности, [148]).
Модель Шанжё является формальной и феноменологической. Она не учитывает реального строения мембран. Дальнейшее развитие этой термодинамической теории связано с рассмотрением нестабильностей, с применением формализма неравновесной термодинамики [149]. В ряде теоретических работ развита и кинетика кооперативных процессов применительно к мембранам [150, 151]. Предложены кинетические модели кооперативного мембранного транспорта. Теория нелинейной кинетики строится с помощью модели Изинга. Осцилляционное поведение мембран рассматривается далее в § 8.9.
Теория мембранного транспорта и взаимодействия мембран с различными лигандами в дальнейшем будет основываться на рассмотрении реальных молекулярных моделей. Такого рода модели, как уже сказано, с успехом применялись к рассмотрению фазовых переходов в двойном слое липидов. Главная трудность будущей теории состоит в анализе динамики взаимодействия белков и липидов. Мембранные рецепторы, — по-видимому, белки (в случае фоторецепции это родопсин), — связавшись с лигандами, меняют свою конформацию, что приводит к изменению глубины погружения и подвижности белков в «липидном море». Причина кооперативности может лежать во взаимодействии «плавающих» белков при их столкновениях. Динамическая мозаичная модель должна послужить основой реалистической молекулярной физики мембран.
Можно считать, что конформационные свойства мембран определяются электронно-конформационными взаимодействиями (ЭКВ, см. [131, 152]). Локальный сдвиг электронной плотности, возникающий при взаимодействии рецептора мембраны с лиган - дом, влечет за собой конформационные перестройки биологических молекул. Тем более это относится к прохождению через мембрану заряженных ионов, которое можно трактовать как распространение конформонов [153] — условных квазичастиц, состоящих из носителя электрического заряда, или сдвига электронной плотности и конформационных смещений окружающей среды. Такие представления особенно важны в применении к мембранам митохондрий и хлоропластов, в которых осуществляется электронный транспорт (см. гл. 6, 7).