ЭЛЕКТРОННО-КОНФОРМАЦИОННЫЕ ВЗАИМОДЕЙСТВИЯ
Самые общие соображения показывают, что перенос электрона, сдвиг электронной плотности в конденсированной ср. еде должны сопровождаться изменениями положений атомов, атомных ядер среды. Все степени свободы молекулярной системы, т. е. системы, состоящей из ядер и электронов, взаимосвязаны. В биополимерной системе наименьших затрат энергии требуют повороты атомных групп, т. е. конформационные движения. Следовательно, в такой системе электронный транспорт сопряжен с конформационными движениями, и должны реализоваться электронно-конформационные взаимодействия (ЭКВ) (см. [3], § 6.7, [72'). Конформационные перестройки должны сопровождать и перемещение ионов. Движение электрона (и зарядовой плотности) в биополимерной системе, в частности, в мембране, сопряженное с конформационными движениями, может трактоваться как перемещение квазичастицы — конформона [73]. В надмолекулярной системе конформационные перестройки могут приводить к механическому движению на макроскопическом уровне.
Эти общие представления, в той или иной форме фигурирующие в научной литературе, применяются рядом авторов к рассмотрению процессов, протекающих в митохондриальных мембранах. В работах Грина и Джи [26, 27] предложена так называемая электромеханохимическая модель структуры и функции митохондрий, исходящая из рассмотрения конформационных свойств элементарных частиц митохондрий (ЭЧМ, см. стр. 308). Предполагается, что ЭЧМ может существовать в различных конформационных состояниях — в основном неэнергизованном состоянии и в возбужденном, метастабильном энергизованном состоянии. Свободную энергию данного состояния можно представить в виде суммы химической, электрической и механической энергий
G = °хим + °эл + Омех. (6.67)
При переходе из основного состояния в энергизованное, не сопровождаемом суммарным изменением свободной энергии, AG = 0 и, следовательно,
Д0х11и + Д0,л + Д0иех = 0. (6.68)
Отдельные вклады в этой сумме могут изменяться, т. е. имеется электромеханохимическое сопряжение — один вид энергии превращается в другой. Элементарную модель системы с взаимопревращением трех видов энергии можно представить двумя противоположно заряженными телами, соединенными пружиной. При колебаниях такой системы происходят взаимные превращения электростатической, потенциальной и кинетической энергий.
Грин и Джи считают, что ЭЧМ характеризуется направленным разделением зарядов при энергизации. Энергизапия является результатом каталитической конверсии химической энергии субстрата в энергию супермолекулы, т. е. ЭЧМ. Возникающее вследствие энергизации электрическое поле индуцирует дополнительное поле в других структурных компонентах ЭЧМ. Энергизованное состояние стабилизуется электростатическими взаимодействиями. В этом метастабильном состоянии оказывается возможной эндергоническая химическая реакция (фосфорилирование), происходит дезэнергизация, и система релаксирует в конечное состояние, конформационно сходное с начальным. Триггером деполяризации системы являются локальные конфор - мационные перестройки в активных центрах. Окисление происходит в нижней части супермолекулы (в подставке ЭЧМ), фосфорилирование — в ее верхней части (в головке ЭЧМ).
Имеются поучительные черты сходства и различия этой модели и топливного элемента. В топливном элементе химические реакции, протекающие как при поляризации, так и при деполяризации, имеют характер окисления и восстановления, в модели ЭЧМ такова лишь реакция в нижней, но не в верхней части. В топливном элементе обе реакции относятся к экзергониче - ским, в модели ЭЧМ поляризация является экзергонической, а деполяризация — эндергонической реакцией. В топливном элементе происходит реальный перенос электронов, в модели ЭЧМ нет переноса электронов между участком окисления и участком фосфорилирования, и дело сводится к возникновению и действию электрического поля.
В процессе энергизации при гидролизе АТФ происходит конформационная поляризация головки ЭЧМ, что индуцирует поляризацию основания.
Согласно изложенным выше идеям, изменение свободной энергии в ходе фосфорилирования слагается из изменений химической и электромеханической энергий, причем два таких вклада дополнительны друг к другу.
В работе [26] предлагается далеко идущая детализация структуры ЭЧМ и локализация в них различных стадий окислительного фосфорилирования. Такая детализация (октетная структура головки и т. д.) реальных оснований не имеет. Равным образом нельзя считать аргументированными конкретные представления о конформационных состояниях ЭЧМ, различающихся выдвижением головки на 50 А. Укажем в связи с этим на еще не вполне опровергнутые сомнения в самом существовании таких структур (см. стр. 290).
Грин и Джи считают электромеханохимическую модель альтернативной хемиосмотической модели Митчелла. В последней модели мембранный потенциал генерируется вследствие перемещения протонов в пространстве между кристами и ионов ОН~ в матриксе, вызванного перемещением электронов и переносчиков водорода во внутренней мембране. В электромехано - химической модели мембранный потенциал возникает непосредственно в результате окислительно-восстановительного процесса в ЦПЭ. Разделение зарядов в электронно-транспортной системе объясняется локализацией переносчиков электронов в одной части внутренней мембраны и переносчиков протонов—в другой ее части. Другое различие состоит в том, что в модели Грина и Джи протоны, отделенные от окисляемого субстрата, не покидают мембранную фазу. Изменение рН во внешней среде считается результатом конформационных перестроек белков вблизи разделенных зарядов и воздействия этих перестроек на состояние внешней среды и матрикса.
В действительности между двумя моделями нет принципиальных противоречий. В сущности, их трудно сравнивать. Хе - миосмотическая теория является феноменологической, ее основные постулаты и выводы не зависят от локализации стадий окислительного фосфорилирования. Модель Грина и Джи существенна в том отношении, что в ней в явной форме фигурируют конформационные перестройки мембранной структуры, несомненно происходящие в действительности. Недостаток модели— чрезмерная ее детализация, лишенная достаточно строгих оснований. Поэтому конкретный механизм электромехано - химического сопряжения, предлагаемый Грином и Джи, имеет умозрительный характер. Согласие модели с рядом опытных фактов (см. [26, 27]) нельзя считать ее доказательством.
Конформационная концепция Грина, из которой исходит электромеханохимическая модель, формулируется им как универсальная [74]. Грин подчеркивает четыре основных принципа биоэнергетики: 1) конверсия тепловой энергии в электромеха - нохимическую, осуществляемая белком, 2) способность энерги - зованного фермента поляризовать чувствительные связи в молекуле субстрата, выполняющей цикл поляризации и деполяризации, 3) сопряжение переноса групп, 4) энергетическое сопряжение посредством комплементарных, векторных потоков зарядов в центрах экзергонических и эндергонических реакций. Фермент считается упругой трехмерной средой, совершающей колебания как целостная система. Молекулы белка периодически переходят из растянутого состояния в сжатое и обратно с частотами порядка 103—106 с-1, отвечающими частотам ферментативных реакций. В ходе этих колебаний происходит переход одной формы энергии в другую, возникает конформация, соответствующая выполнению специфической работы, и понижается активационный барьер реакции превращения субстрата в продукт. Фермент есть машина, превращающая тепловую энергию в электромеханохимическую в фазе энергизации и выполняющая обратное превращение в фазе дезэнергизации. Грин возлагает надежды на исследования медленных колебаний ферментов методом комбинационного рассеяния с использованием лазерной техники.
Каталитическое действие фермента определяется поляризацией субстрата: фермент служит поляризующим агентом, а субстрат — поляризуемым веществом. В окислительных реакциях взаимодействие фермент — субстрат включает перенос электронов.
Эти качественные представления согласуются с неоднократно высказывавшимися идеями (см. [3], § 6.7, а также [75—77]). В общем виде они не могут вызвать возражений, однако истинная физика электронно-конформационных взаимодействий требует количественных теоретических и экспериментальных исследований. При этом вряд ли можно рассчитывать на прямое изучение медленных колебаний ферментов методом комбинационного рассеяния, так как медленные колебания несомненно существуют и в окружающей среде и их наблюдение весьма затруднительно.
Говоря о митохондриальных мембранах, необходимо прежде всего экспериментально установить наличие в них конформационных превращений. В § 3.8 уже были приведены некоторые данные такого характера, относящиеся к возбудимым мембранам. Здесь мы остановимся на результатах, полученных с помощью молекулярных меток, или зондов, — люминесцентных [78] и главным образом спиновых. Исследования биомембран митохондрий, меченных иминоксильными радикалами, методом электронного парамагнитного резонанса были проведены в работах Блюменфельда, Кольтовера и др. [79—84'. С помощью спиновых меток была изучена сорбция воды мембранами лио - филизованных СМЧ (а также хлоропластов, см. гл. 7). Время корреляции т, определенное из спектра ЭПР и характезирую - щее подвижность метки, оказалось немонотонно зависящим от содержания сорбированной воды — с его увеличением т проходит вначале через минимум, затем достигает максимума, после чего монотонно убывает. Эти результаты можно считать указанием на структурные переходы у молекул в мембране, имеющие кооперативный характер. При переходе увеличивается число гидрофильных групп, контактирующих с водой и, следовательно, сорбирующая поверхность мембраны. Переходы происходят при концентрациях воды в препарате, равных 8—12 и 18—23%- Авторы связывают первый переход с гидратацией, второй — с изменением фазового состояния липидов в мембране. Такое толкование нельзя считать однозначным, но наличие переходов установлено.
Установлено также, что восстановление дыхательной цепи СМЧ сукцинатом или НАД-Н изменяет анизотропию спектра ЭПР спиновой метки. Более четкие результаты дали работы с гидрофобными метками. Оказалось, что добавление АТФ к суспензии неэнергизованных СМЧ вызывает значительные изменения спектра ЭПР — АТФ улучшает растворимость гидрофобной метки в мембранах СМЧ. По-видимому, такое изменение определяется конформационными изменениями структуры мембраны. Сходное влияние АТФ наблюдается и в интактных митохондриях. ДНФ и олигомицин в концентрациях более 1 мкг на 1 мг белка ингибируют этот процесс. При малых концентрациях (0,1—0,2 мкг на 1 мг белка) олигомицин подобно аллостериче - ским активаторам усиливает индуцированные АТФ конформационные переходы в СМЧ. Изучение мицелл фосфолипидов, полученных из митохондриальных мембран, показало, что разобщители вызывают конформационные изменения липидов.
Зависимость параметра солюбилизации гидрофобной метки в мембране от концентрации АТФ имеет S-образную форму. Это свидетельствует о кооперативности перехода (см. [3], §7.5).
Параметр Хилла для такой кривой равен 6, в присутствии олигомицина он убывает до 5 и даже до 4. Разность свободных энергий оценена в 1,8 ккал/моль. Примерно такие же величины получаются при обработке Данных по действию ингибитора ан - тимицина на скорость дыхания [85]. Кривая зависимости инги - бирования восстановления цитохрома b в СМЧ [86] характеризуется параметром Хилла, равным 4,5, и AG = 2,3 ккал/моль независимо от природы донора электронов. Высокая коопера - тивность этих процессов указывает на олигомерное строение мембран.
Анализ температурной зависимости параметров спектров ЭПР спиновых и флуоресцентных меток в СМЧ (а также в хлоропластах и в микросомах) показал существование термических структурных переходов в мембранах вблизи 20 и 40 °С. При таких температурах происходят скачкообразные изменения энергии и энтропии активации ферментативных процессов.
Ограничимся этими немногими фактам. Все они (а также ряд других результатов) указывают на наличие конформационных превращений в митохондриальных мембранах, в частности, возникающих при их энергизации. Таким образом, исходное положение электромеханохимической гипотезы можно считать вполне приемлемым. Однако физика соответствующей модели действия сопрягающих мембран не может еще считаться разработанной.
Блюменфельд [79, 83] выдвинул гипотезу релаксационных конформационных переходов в митохондриальных мембранах. Допустим, что элементарный акт состоит в присоединении электрона к активному центру макромолекулы (скажем, к группе гема цитохрома при его восстановлении). Нейтральной форме макромолекулы соответствует определенная равновесная кон- формация I, заряженной (восстановленной)—другая равновесная конформация II, заметно отличающаяся от исходной. Электронный перенос, т. е. восстановление, происходит значительно быстрее конформационного изменения. Следовательно, при протекании элементарного химического акта образуется неравновесное конформационное состояние — электрон перешел, но конформация не успела подстроиться к новой ситуации. В этом состоянии структура макромолекулы напряжена, она обладает повышенной конформационной энергией.. Затем происходит медленная релаксация конформация макромолекулы к равновесному состоянию II. Переход можно представить схемой (минус обозначает электрон)
1 быстро^ 1 медленно"*" И быстро"*" И медленно"*"
Энергия, выделяемая в элементарном акте, запасается в форме конформационной энергии в течение времени релаксации. Согласно [79, 83] в этом и состоит сущность первичного макроэрга. За время релаксации конформационная энергия трансформируется в химическую. Можно думать, что в пункте сопряжения существует лабильный комплекс между переносчиком и какой - либо группой в активном центре фермента сопряжения, роль которой скорее всего играет аденин связанного АДФ [87]. При релаксации 1~ —>• II - в какой-то момент энергетический уровень, на котором находится электрон, понижается до акцепторного уровня аденина. Уровни переносчика и аденина оказываются разделенными барьером, но в такой системе возможен туннельный переход электрона на аденин [88]. В работе [89] (см. также [79]) показано, что увеличение электронной плотности на аде - нине сопровождается резким повышением основности аминогруппы. Если в состав активного центра фермента сопряжения АТФ-синтетазы входит электрофильная группа, например, карбоксил, то аденин реагирует с нею, образуя амидную связь. В следующий момент релаксации уровень переносчика оказывается ниже уровня аденина. Электронная плотность переходит с аденина обратно на редокс-группу того же или следующего переносчика электрона ЦПЭ, и связь аденина с карбоксилом лабилизуется. На основе той же модели рассмотрено действие разобщителей.
В работах Блюменфельда и Чернавского [90—92] (см. также [79, 111]) дано обобщение этой концепции применительно к трактовке элементарного акта любой ферментативной реакции. Формулируется «постулат, согласно которому конформационное изменение субстрат-ферментного комплекса, следующее за присоединением субстрата к активному центру фермента, включает в себя кроме разрыва старых и образования новых вторичных связей в макромолекуле белка также химические изменения субстрата, превращающие молекулу субстрата в молекулу или молекулы продукта. Таким образом, элементарный акт ферментативной реакции заключается в конформационном изменении макромолекулы (фермент-субстратного комплекса), и скорость превращения субстрат — продукт определяется скоростью этого конформационного изменения». На рис. 6.19 приведена схема энергетических изменений на разных стадиях каталитического разрыва некоторой связи А—В субстрата. В быстрой стадии 1 присоединения субстрата к ферменту происходит выделение свободной энергии ДG\. Конформация белка не успевает перестроиться и остается напряженной. На стадии 2 происходит медленная релаксация комплекса к новому равновесию и превращение субстрата в продукт (Е— новая конформация фермента). Свободная энергия понижается на величину AG2. Далее, в стадии <9 комплекс распадается на фермент и продукт, но фермент остается в напряженной конформации Е,
|
Щ |
|
|
Щ |
Ч |
А—8 + Е (А—6)Е АЕВ Е + А+В-^Е + А+В
Рис. 6.19. Энергетические изменения в последовательных стадиях каталитического процесса.
Медленно релаксирующей к равновесию в стадии 4. Общее понижение свободной энергии равно
AG = А С?! Н - AG2 + AG3 + AG4. (6.68а)
Это — термодинамическая модель. Кинетика процесса в цитированных выше работах фактически не рассматривается. Блю - менфельд считает уравнение Аррениуса или Эйринга неприменимым к ферментативным реакциям [79, 91]. Утверждается, что система не характеризуется свободной энергией активации в обычном смысле слова — все молекулы субстрата, образовавшие надлежащий комплекс с ферментом, релаксирующим к новому конформационному состоянию, претерпевают химическое превращение. Влияние температуры на скорость реакции определяется не изменением числа молекул, способных преодолеть некоторый активационный барьер, но изменением исходной конформации и, следовательно, пути и скорости последующей релаксации [92] (см. также [79, 111]).
Для построения кинетической теории необходимо исследовать относительную роль двух механизмов переноса электрона — надбарьерный переход по Эйрингу (см. [3], § 6.1) и туннельный эффект (см. [79, 92, 111]). Туннельный эффект при переносе электрона в биологической системе был впервые рассмотрен Чансом применительно к бактериальному хлорофиллу [114—116].
І I М. В. Волькенштейн
Константа скорости активационного перехода равна
= ехр (_£), (6.69)
+
Где F+ — свободная энергия активации. Число актов туннельного перехода в единицу времени равно
K2 = Vq ехр [- V2т {U - Е) ], (6.70)
Где vo — частота «колебаний электрона» в молекуле, участвующей в цепи переноса, скажем, в цитохроме с — величина порядка
Белков и липидов; соответственно, ширины барьеров L порядка размеров этих молекул, т. е. 10—20 А.
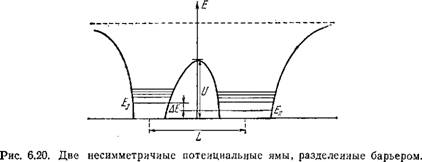
Поведение электрона при его туннелировании зависит от соотношения между разностью электронных уровней ДЕ (см. рис. 6.20) и величиной резонансного расщепления
AEr = Eexp[-j л/2т(£/-£)]. (6.71)
Если ДЕ ДЕг, то туннельного перехода не будет. При АЕ^.АЕГ переход произойдет за время тг = h/AEr. При L«20A, U — Е ж 2 эВ, АЕГ ~ 10~6 эВ. Реальные значения ДЕ в ЦПЭ должны быть много больше, и такой идеальный переход невозможен. Туннелирование становится, однако, возможным вследствие диссипации энергии, обеспечивающей сближение электронных уровней. Именно ЭКВ создают возможность такой диссипации. Чернавская и Чернавский [111] рассматривают случай потенциальных ям, защищенных от ионной среды неполярной оболочкой. Вблизи места локализации электрона можно выделить лишь несколько заряженных групп, сильно связанных с электроном. Рассматривается в качестве предельного случая лишь одна колебательная степень свободы. В этой ситуации возможно возбуждение колебательного кванта hк, причем
Д£ = ficoK = £К; (6.72)
Или увеличении энергии уже присутствующего кванта
АЕ = АЕК = Н Д®к. (6.73)
Значения Ек и Д£к порядка 0,1 эВ. Вероятность туннельного перехода при условии (6.72) выражается формулой
А; = р (ДЕ) g2 ехр[- Ц - <s/2m{U - Е) ]. (6.74)
Здесь р(Д£)—плотность уровней конечного состояния, g2 = = Ю-2—10~4—константа, характеризующая «силу связи». Если имеет место случай (6.73), то
®=^р(Д£-Д£к)ехр(-|^-)ехр[--^ л/2m(U - Е)\ (6.75)
Функцию р можно представить либо в лорентцовой, либо в гауссовой форме. Последняя имеет вид
Она имеет резкий максимум при АЕ = АЕК и быстро убывает при АЕ~ Д£К>ГК. Ширина резонансной области Гк порядка Ю-2 эВ.
Электронно-конформационные взаимодействия (по терминологии Чернавского электронно-конформационные переходы, ЭКП) могут трактоваться именно таким способом. Как указано в цитированных выше работах (см. [3], § 6.5, а также [72, 73, 111]), ЭКВ происходят при попадании электрона в поляризуемую среду, образованную группами макромолекулы. Среда поляризуется, и образуется самосогласованное поле, эквивалентное потенциальной яме для электрона. Такое образование в физике твердого тела называется поляроном. Если поляризационная деформация приводит к состоянию, отделенному от исходного энергетическим барьером, то мы имеем дело с нелинейным поляроном. В биополимерах поляризация приводит к движению по конформацнонный степеням свободы — нелинейный полярон является конформоном.
Чернявская и Чернавский дают грубую оценку энергии и размеров конформона [111]. В среде, содержащей равномерно распределенные ионы массы М, взаимодействующие по закону Кулона, имеем согласно теореме вириала
'/2 Mv2 « е2/г. (6.77)
Скорости v и расстоянию г соответствует частота колебаний
V / 8я е2 _оч
®к = т = д/— ЖП, (6.78)
Где п = (4/ззхг3)-1 — число ионов в единице объема. Взаимодействуя с колебаниями ионов, электрон приобретает энергию ficoK и
4
Импульс <7 = д/2шЙсок = д/Am2h2a>\, где т — масса электрона. Согласно соотношению неопределенностей соответствующий размер электронного облака равен
4 4
» =А — ^ /-Л * /JL ^ Г h2M
Q 2отсйк — Л/ 32я Л/ т2е2п '
Вводя боровский радиус ао = Ь2/те2 « 0,5 А, получаем
Х - IfJI л/Ж = "о л/IF л/^ ■ (6-79)
V 32п \ тп V 32я \J т па\ v '
Размеры полярона (конформона) должны быть того же порядка. Энергия поляризации по порядку величины равна
Где є— микроскопическая диэлектрическая проницаемость. Наконец, отношение Ер к энергии колебаний дает число квантов, участвующих в образовании полярона,
JV = Ј;//jo)k. (6.81)
Для белков среднее значение плотности зарядов я ~ 1021 см-3, т. е. расстояние между зарядами порядка 10 А. Если заряды расположены на протонах, то М = (6,2-1023)~' г. Величину є можно считать равной 3. Получаем сок я* 3,5-1013 с-1, размеры полярона Я « 15 А, т. е. поляризацией охвачена практически вся макромолекула. Энергия поляризации Ер « 0,35 эВ, сдвиг уровней электрона того же порядка. Наконец, N примерно равно 15.
В кинетике электронно-конформационных переходов можно выделить четыре процесса [111].
Колебания электрона внутри одной ямы, размером в несколько ангстрем, с частотами порядка 1017 с-1.
Колебания атомов с частотами порядка k^T/h ~ 1013 с-1 и с амплитудами порядка Ю-1—Ю-2 А; частоты упругих колебаний белковой глобулы как целого порядка I0-i2—10~" с-'.
Туннелирование электрона; как уже сказано, ему отвечают времена порядка Ю-7—Ю-6 с и расстояния порядка 10—20 А.
Конформационные переходы в макромолекуле с временами 10_3—Ю-1 с; возможны и значительно более медленные переходы (см. § 8.6).
Соответственно можно не рассматривать быстрые процессы 1), 2), 3) и пользоваться усредненными по времени значениями электронной плотности в ямах и усредненными положениями колеблющихся атомов. Именно такая процедура применена в описанной выше модели релаксационных ЭКП. Молекула — акцептор электрона, получив электрон, оказывается в неравновесной конформации, медленно превращающейся в равновесную. Поэтому для туннельного эффекта требуется не совпадение электронных уровней восстановленных донора и акцептора в их равновесных конформациях, но наличие надлежащим образом расположенного виртуального электронного уровня акцептора в окисленной конформации. Энергия, выделившаяся при тунне - лировании, диссипирует, но энергия, медленно выделяемая при конформационной релаксации к новому равновесному состоянию, может быть конвертирована в энергию макроэрга (ср. также [93]). Так как туннельный эффект связан с условиями резонанса электронных уровней энергии, он подвержен влиянию мембранного потенциала. Следовательно, возможен регулятор - ный процесс, состоящий в том, что мембранный потенциал, создаваемый активным транспортом ионов, зависит от скорости переноса электронов, которая, в свою очередь, регулируется мембранным потенциалом. Реализуется обратная связь, обеспечивающая автоматическое поддержание системы в условиях, близких к резонансным [79].
Изложенная концепция дает гипотетическое качественное описание электронно-конформационных взаимодействий в фермент-субстратном комплексе. Однако мы не располагаем пока теорией, количественно объясняющей скорость ферментативной реакции, в частности, кинетику переноса электронов в мито - хондриальной системе. Задача такой теории состоит в нахождении поверхности свободной энергии фермент-субстратного комплекса как целостной системы, обладающей электронными и кон - формационными. степенями свободы, и в нахождении пути процесса. Сама эта поверхность действительно должна меняться с температурой.
При рассмотрении пути процесса следует учитывать «кон- формационную» природу явления. Иными словами, положения электронных уровней энергии зависят от динамического состояния среды — белка, обладающего конформационными степенями свободы. Вследствие медленности конформационных движений система является адиабатической. Основные положения упрощенной модельной теории, развитой в работах [94—96], изложены в § 6.7 книги [3]. В последующих работах Кришталика [97] проведено более детальное рассмотрение фермента, учитывающее наличие в его молекуле большого числа полярных групп, обладающих ограниченной подвижностью. В этих условиях в ходе процесса должен осуществляться перенос заряда в положения, оптимальные для заданной конфигурации Диполей. Тем самым реализуется определенная предоргани - зация среды, способствующая повышению скорости ферментативных реакций и благоприятствующая эстафетному переносу зарядов на дальние расстояния. Рассмотрено также одновременное прохождение двух реакций переноса заряда. При благоприятных геометрических условиях возможно сильное сопряжение двух процессов, в частности, протекание эндергонической реакции за счет экзергонической.
Теория Блюменфельда и Чернявского, основанная на рассмотрении ЭКВ, существенно отлична от модельных представлений, используемых в феноменологической теории Митчелла. Представления об ЭКВ (или ЭКП) имеют более реальные и глубокие физические основания. Переход от этих представлений к феноменологическому, общему описанию и его согласование с положениями теории Митчелла, подтвержденными опытом, по - видимому, окажутся возможными в дальнейшем. Для этого необходимы не грубые оценки и качественные гипотезы типа предложенных в работах [26, 73, 74, 90], но подлинная количественная теория конформона (или нелинейного полярона). Такая теория пока не создана. Ее построение связано с исследованиями конкретных процессов, учитывающими детали поведения элек - тронно-конформационной системы. Эти детали не могут быть получены из умозрительной картины (см. [26]), но лишь из экспериментальных данных, которых дока недостаточно. Тем самым сейчас нет еще возможности строить атомно-молекулярную теорию ЦПЭ в целом. Следует начать с рассмотрения отдельных звеньев процесса, с изучения поведения отдельных ферментов — переносчиков электронов.
Были проведены рентгеноструктурные исследования окисленной и восстановленной формы цитохрома с [98—100].
Среди участников ЦПЭ в митохондриях именно цит с наиболее доступен для изучения переносчиков электронов. Этот белок можно выделить в чистой форме и закристаллизовать. Остальные компоненты удается пока выделить лишь в виде мульти - ферментных комплексов: цитохромы 6 и Сі как комплекс цито - хромредуктазы и цитохромы а и а% как цитохромоксидазу. Ре - дуктаза снабжает цит с электронами, оксидаза отбирает их у цит с.
Задолго до рентгенографических исследований было проведено изучение первичной структуры цит с из более чем 40 различных организмов, начиная с низших растений и кончая обезьянами и человеком (см. [3], § 2.5, [10]). Результаты этих работ очень существенны и в биологическом, и в биофизическом аспектах.
Молекулы цит с позвоночных содержат 104 аминокислотных остатка, насекомых—107, низших растений—107—109, высших растений— 111 (в одном случае 110). Последовательности остатков хорошо отражают биологическую эволюцию. Так, первичные структуры цит с человека и шимпанзе тождественны, отличаясь от структуры цит с обезьяны резуса только одной заменой из 104 остатков — у резуса на 102-м месте фигурирует Ала, вместо Тре. Цит с гремучей змеи отличается от цит с пекарских дрожжей добавлением 5 остатков с N-конца, удалением последнего остатка с С-конца и 40 заменами, а от цит с человека—12 остатками. Примечательно, что большинство замещений во всех исследованных цит с консервативно в том смысле, что мутационная замена сохраняет характер остатка. Можно разбить аминокислотные остатки на 6 классов: гидрофобные ароматические (Фен, Трп, Тир), гидрофобные алифатические (Иле, Лей, Мет, Вал), гидрофильные основные (Гис, Лиз, Apr, Лиз — СН3), гидрофильные кислотные (Асп, Глу), амбивалентные, т. е. малые гидрофобные или незаряженные полярные (Ала, Асн, Цис, Про, Глн, Сер, Тре) и, наконец, остаток глицина Гли, не имеющий боковой цепи. Оказывается, что эволюционные изменения цит с во всей живой природе от низших растений до человека сводятся, как правило, к замещениям внутри одного класса, и лишь в малом числе случаев к изменению класса остатка. Это указывает на далеко идущее сходство пространственной структуры всех цит с.
В ходе эволюции клетки перешли от анаэробных процессов к дыханию как источнику энергии. Именно на этой стадии, реализовавшейся примерно 1,2 миллиарда лет назад, возникли ци - тохромы. Это весьма древние белки, функциональная структура которых очень точно стабилизована естественным отбором, о чем свидетельствует то обстоятельство, что цитохромы с, выделенные из любого эукариота — растения, животного или микроорганизма, реагируют in vitro с цитохромоксидазой любого другого вида [101].
Сходство структуры всех цитохромов с выражается не только в постоянстве расположения 6 классов остатков. Некоторые участки цепи вообще не варьируют. 35 из 104 положений заняты одними и теми же остатками в цит с всех изученных видов, включая длинную последовательность от 70-го до 80-го остатка:
Асн — Про — Лиз — Лиз — Тир — Иле — Про — Гли —
Тре — Лиз — Мет —
35 инвариантных мест заняты 15 различными остатками. Другие 23 места заняты только одним или двумя различными, но весьма сходными остатками. В 17 местах возможны лишь замены в пределах трех остатков на каждом месте. С другой стороны, имеются немногие места, для которых оказываются допустимыми самые различные замены; сюда относится, например, остаток № 89 [101].
Эти свойства первичной структуры всех цитохромов с показывают, что пространственное строение фермента, ответственное в конечном счете за его биологическую функциональность, фиксировано достаточно строго. Мутационные нарушения первичной структуры, приводящие к сколько-нибудь существенным изменениям строения глобулы, элиминируются естественным отбором, будучи летальными. В этом смысле цит с фиксирован точнее, чем гемоглобин, не говоря уже о фибриллярных белках, но менее строго, чем гистоны (см. стр. 46).
Таковы важные выводы, которые следуют из изучения первичных структур 40 различных цитохромов с. Ответ на вопрос о смысле наблюдаемого консерватизма последовательности остатков дает рентгеноструктурный анализ.
На рис. 6.21 изображена структура окисленного цитохрома с лошади, установленная Дикерсоном и его сотрудниками [101]. Ее рассмотрение показывает, что группа гема соединена пятой и шестой валентностями атома железа с имидазольным кольцом Гис 18 и атомом серы Мет 80. Гем связан ковалентно также с Цис 14 и Цис 17. Гем расположен в глубокой выемке, причем его окружение весьма консервативно в эволюции. Инвариантная последовательность 70—80 также является частью ближайшего окружения гема.
Структура цит с характеризуется, как обычно, расположением гидрофобных остатков внутри молекулы (см. [3], § 4.6, 4.7),
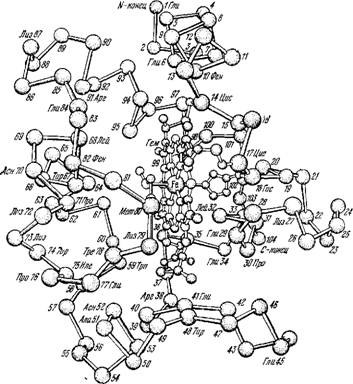
Рис. 6.21. Структура окисленного цитохрома с лошади.
Тогда как заряженные группы, кислотные или оснбвные, находятся на ее поверхности. Среди последних групп существенны остатки Лиз, число которых велико — оно равно 19. Очевидно, что определенное расположение зарядов на поверхности молекулы важно как для фиксированной структуры глобулы, так и для электростатических взаимодействий с оксидазой и редукта - 80Й Химические исследования показали, что взаимодействие цит с с охсидазой действительно имеет электростатический характер, причем положительные заряды расположены на цит с, ц отрицательные — на комплексе. Блокировка заряда Лиз 13, находящегося на правой части молекулы, сильно уменьшает это взаимодействие. Положительные заряды на другой стороне молекулы, по-видимому, взаимодействуют с редуктазой. В этой области находятся и три ароматических остатка: Фен 62, Тир 74 и Тир 67.
Таким образом, молекула цит с представляет собой упорядоченную систему, молекулярную машину, предназначенную для переноса электрона в результате определенного взаимодействия с оксидазой и редуктазой.
Пока нет прямой информации о том, как эта машина работает, что происходит при транспорте электронов с составляющими ее элементами. Из общих представлений об электронно - конформационных взаимодействиях (см. § 6.6) следует, что функциональность цит с определяется конформационными перестройками молекулы при переходе из окисленного в восстановленное состояние и обратно. Это подтверждается химическими исследованиями [102, 103], дающими, однако, ограниченную информацию.
В работе [100] проведено рентгенографическое исследование восстановленного цит с из сердца тунца с разрешением до 2,45 А. Результаты этого исследования сопоставлены с данными для окисленного цит с. Таким образом, установлены структуры для двух конечных состояний окисления и восстановления цитохрома с.
Структура глобулы окисленного цит с тождественна для лошади и рыб — бонито и тунца. Кристаллы для всех цит с изоморфны, они относятся к пространственной группе Р43.
Напротив, восстановленные цит с рыб бонито и тунца не изоморфны, их пространственные группы соответственно P2i2i2i [101] и P2[2i2 [100].
Сравнение полученных структур восстановленного и окисленного цитохромов с показывает, что в целом они похожи. В обоих случаях гем погружен в полость молекулы, его ковалентные связи с белком одни и те же. Сходно и расположение водородных связей.
Полость, в которой расположен гем, образована слева остатками 80—84, задняя стенка полости состоит из боковых цепей Иле 9 и Иле 85 и Лей 68 и 94. Иле 81 находится на краю полости. Вблизи гема расположено 7 «критических» ароматических остатков, сохраняющихся в эволюции. На дне полости находится пара Тир 48 —Фен/Тир 46, справа пара Фен 10 —Тир/Фен 94 и между гемом и поверхностью молекулы триплет Тир/Фен 74 — Трп 59 — Тир/Фен 67. Инвариантен также остаток Фен 82.
Майер и Пал изучали влияние последовательной модификации метионинов, тирозилов и триптофанилов N-бромсукциними - дом (БСИ) при рН 4,1 [105, 106]. При отношении БСИ : белок до 3,3 : 1 Мет 65 и Трп 59 окисляются. При отношении 5 : 1 разрушается и Тир 74. При этих химических изменениях резко падает редуктазная активность НАД-Н-цитохрома с, и ее падение пропорционально доле окисленного Трп 59. Одновременно происходит более медленное падение оксидазной активности цитохро - ма с. Если отношение БСИ : белок более 5 : 1, происходит модификация второго (не идентифицированного) Тир и окисление Мет 80, что приводит к потере оксидазной активности.
Эти результаты показывают, что Трп 59, по-видимому, участвует в восстановлении цит с. Исходя из этого и из предварительных данных рентгеноструктурного анализа, Дикерсон и Уинфилд предложили модельный механизм восстановления цит с, состоящий в следующем [101].
Один электрон каким-то способом переносится от редук - тазы на Тир 74 и вследствие перекрывания я-электронных облаков с Тир 74 на Трп 59. Если избыточный электрон попал на Тир 74, он спонтанно мигрирует на Трп, так как более протяженная кольцевая система делокализации Трп обладает более низкой антисвязывающей орбиталью, которую может занять электрон.
Другой электрон переносится с Тир 67 на гем, оставляя Тир 67 с нехваткой электрона. Здесь также электрон переходит с меньшей системы делокализации на большую, обладающую более низкими уровнями энергии. Этому переходу способствует электростатическое отталкивание, создаваемое избыточным отрицательным зарядом на Трп 59, хотя прямой переход электрона с Трп 59 на Тир 67 невозможен вследствие отсутствия перекрывания я-электронных облаков.
Происходит конформационное изменение, в результате которого кольца Трп 59 и Тир 67 устанавливаются параллельно и их я-облака перекрываются. Этому превращению способствует электростатическое притяжение обогащенного электроном Трп 59 и имеющего нехватку электрона Тир 67.
Электрон затем переносится с Трп 59 на Тир 67, обе группы становятся электрически нейтральными, и молекула остается в наблюдаемой конформации восстановленного цитохрома с. Последний электронный перенос облегчается малой диэлектрической проницаемостью внутренней гидрофобной молекулы.
Редфилд и Гупта [107] установили методом ЯМР, что в окисленном цитохроме с неспаренный спин гема проводит большую часть времени на пиррольном кольце, связанном с Цис 17, и на противоположном кольце по диагонали, погребенном в глубине кармана. Это последнее пиррольное кольцо находится в тесном контакте с Тир 67. Спаривание электронов в этой части порфи - ринового кольца должно способствовать переносу электрона с Тир 67 на гем.
Данные об участии ароматических соединений в восстановлении гемина (окисленного гема) были получены путем изучения дисперсии магнитного вращения (ДМВ) (см. [3], § 7.3, 7.4) в модельных системах [108]. ДМВ гемина в безводном пиридине практически довпадает с ДМВ феррокомплекса гема с пиридином. При добавлении воды ДМВ резко изменяется и становится сходной с ДМВ гемина. По-видимому, в отсутствие воды возникают я-комплексы гемина с пиридином. Такие комплексы гемина с сопряженными молекулами в неполярных растворах хорошо изучены, причем показано, что это комплексы с переносом заряда [109]. Сходство ДМВ комплекса гемин — пиридин и комплекса гем — пиридин показывает, что пиридин служит донором электрона, переходящего на гемин. Из этих результатов следует, что в я-комплексе порфиринового кольца и ароматической молекулы (пиридина) происходит перенос электрона и для данного процесса существенна неполярность растворителя, стабилизирующего я-комплекс. Переход электрона должен, очевидно, происходить с понижением энергии, т. е. от менее протяженной я - электронной системы пиридина К более протяженной СИСТЄіМЄ гема.
Укажем попутно, что исследование дисперсии магнитного вращения и магнитного кругового дихроизма (МКД) цитохро - мов очень перспективно для изучения процессов, происходящих в ЦПЭ. Соответствующие работы начаты лишь недавно. Кривые ДМВ и МКД, полученные для взвеси субмитохондриальных частиц, содержат ярко выраженные пики, отвечающие отдельным цитохромам [110]. Обычные спектры поглощения не дают такой ясной картины.
Модель Дикерсона — Уинфилда очень привлекательна — она непосредственно изображает электронно-конформационные взаимодействия. К сожалению, пришлось от этой модели отказаться (см. [117]). Последующие результаты рентгеноструктурного анализа не выявляют заметных различий между структурами окисленного и восстановленного цит с. Найден цит с, в котором Тир 74 заменен на Лей при полном сохранении активности фермента. Поэтому Дикерсон приходит к выводу о туннельном механизме переноса электрона в цитохроме.
В работах [94—97] предложена модельная квантовомехани- ческая теория ферментативного катализа и изложено ее применение к процессу восстановление — окисление цит с. Показано, в частности, значительное ускорение процесса при наличии промежуточных электронных состояний системы, взаимодействующих как с начальными, так и с конечными состояниями. Реакции переноса заряда, такие как Fe3+ Fe2+, сильно ускоряются в присутствии третьей частицы, играющей роль «мостика» для переноса электрона. Функция виртуального мостика рассмотрена в случае цит с, причем получены грубые оценки скорости процесса и зависимости ее от температуры, согласные с опытом.
Таким образом, имеются различные предположения о механизме переноса электрона в цитохроме с. Решение этой проблемы требует, с одной стороны, экспериментального исследования динамики окисления — восстановления, с другой — построения полной квантовомеханической теории процесса, учитывающей и электронные и конформационные степени свободы. Мы встречаемся здесь с очень большими трудностями.