БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Биоэнергетические процессы, приводящие к синтезу АТФ, к зарядке «биологических аккумуляторов», протекают в специализированных мембранах митохондрий. Именно здесь локализованы и пространственно организованы молекулярные системы, ответственные за энергетику живых организмов. Синтез АТФ в митохондриях сопряжен с электронным и ионным транспортом и с механохимическими явлениями. Функции митохондриальных мембран весьма сложны и многообразны. Другой тип биоэнергетических сопрягающих мембран — мембраны хлоропластов растений, ответственные за фотосинтез, — рассматривается в гл.7.
Источником энергии, расходуемой клеткой на биосинтез, активный транспорт, механическую и электрическую работу, является дыхание, т. е. окисление органических соединений кислородом воздуха. В 1780 г. Лавуазье показал, что дыхание и горение имеют единую природу. За последующие почти два столетия исследования химиков, биологов и физиков привели к раскрытию основных особенностей биологического окисления — одного из важнейших процессов (или, скорее, системы процессов), происходящих в живой природе.
Топливо, т. е. окисляемые вещества, поступает в организм животного с пищей в виде жиров, углеводов и белков. Жиры представляют собой триглицериды жирных кислот, главным образом многоатомных. Они расщепляются, т. е. гидролизуются в реакциях, катализируемых специальными ферментами. Жирные кислоты активируются с участием специфических ферментов и АТФ, превращаясь в ацилпроизводные так называемого кофер - мента А, Ко А — SH, структура которого показана на рис. 6.1. Окисление ацилпроизводного Ко А — SH происходит в ряде стадий, на каждой из которых образуется остаток жирной кислоты, содержащий на два атома углерода меньше, чем предыдущий [1, 2]. Полное уравнение реакции окисления жирной кислоты с четным числом атомов углерода до ацетил-S — Ко А имеет вид
Н3С(СН2СН2)„С02Н + АТФ + (п + 1) КоА - SH + лНАД+ +
+ пЕ ■ ФАД + лН20 —>- (п + 1 )CH3COS - КоА +
+ (£5ф + £фч) + "НАД-Н + пЕ - ФАД-Н +
Здесь НАД — кофермент никотинамидадениндинуклеотид (рис.
6.2), Е — фермент, ФАД— кофермент флавинадениндинуклеотид
F.
G он сн, о о щ 1 |
И І і 4 и в „ \ , J;
HS—СН^СН^-МН—G—СН^-СН2—НН—С—СН-С—СН^-О—Р-0—Р-0—CHj, q N^X^/
Сн? о - О" К))
О он он
Рис. 6.1. Кофермент А.
TOC \o "1-3" \h \z (рис. 6.3), АДФ и АМФ — аденозиндифосфат и аденозинмоно - фосфат, Фн, ФФН — неорганические моно - и дифосфаты. Обратим внимание попутно на общность и
Строения АТФ, КоА—SH, НАД и Н В
ФАД (см. [3], гл. 2). При разруше - /\ / \
Нии жиров в конечном счете обра - н| 9 NH2
Зуется ацетил-КоА, а также про - п ^
ПИОНИЛ-КО А И ГЛИЦерИН. - g_p_Q_QH
Расщепление и окисление угле - і | |
Водов (в частности, крахмала) при - \ С^н н^С водит к образованию триозофосфа - і |>с«исг I NH
Тов и пировиноградной кислоты I н L L н I 2
(пирувата). н°-рГ° 0Н 0Н „ /ч
При разрушении белков, наряду / С N
С индивидуальными аминокислота - \ НСч J I
Ми, используемыми в синтезе бел - СН2 0 \
Ков de novo, образуются ацетил - N
Ко А, оксалацетат, а-кетоглутарат, INc^c/I
Фумарат и сукцинат. Эти процессы н і і н
Метаболизма детально изучены в он ОН
Современной биохимии (см. [1,2]). Рис. в-2- Никотинамидаденин-
Основные продукты расщепле - динуклеотид (НАД),
Ния и окисления жиров, углеводов
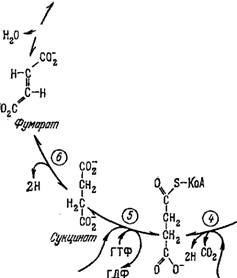
И белков претерпевают дальнейшие превращения в циклической системе реакций, именуемой циклом лимонной кислоты или циклом Кребса. Эта система локализована в митохондриях. Цикл Кребса, «образно говоря, та главная ось, вокруг которой вертится метаболизм почти всех существующих клеток... Цикл
Кребса является «фокусом», в котором сходятся все метаболические пути» [1].
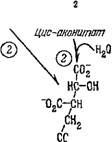
Цикл Кребса изображен на рис. 6.4. За один оборот цикла, состоящего из восьми реакций, отмеченных на рисунке цифрами в кружках, происходит деградация одной молекулы ацетил-КоА
NH. I г
ЛД
?н Т Т Її < 5 L
Н2с—СН—СН—СН—СН,—О-Р-О-Р-О-СН, n-^Ч
III I N'
Н3С X 1 м л 0н °Н С^ Ъ
VVVY М-М
II I I I 1 1
A/\A/NH он он
Н, С V N С s Н II
О
Рис. 6.3. Флавииадениндинуклеотид (ФАД).
Или одной молекулы пиру вата до С02 и Н20, т. е. «сгорание» этих молекул. Соответствующие суммарные реакции имеют вид
CH, COS - КоА + З НАЦ+ + (ФАД) + ГДФ + Ф„ + 2 Н20 —►
—► 2 С02 + КоА — SH + З НАД-Н + (ФАД-Н) + ГТФ + ЗН+, Пируват" + КоА — SH + НАД+ —* CH3COS - КоА + НАД-Н+ + Н+ + С02.
(Скобки обозначают, что ФАД тесно связан с белком.)
От цикла Кребса идут пути многих биосиитетических реакций— пути синтеза углеводов, липидов, пуринов, пиримидииов и порфирннов. Синтез белков также связан с циклом, в котором создаются предшественники ряда аминокислот. Вместе с тем, как мы увидим, биологическое окисление является источником энергии, запасаемой в АТФ и необходимой для биосинтетических процессов.
В реакциях цикла возникают С02 и ионы Н+. Одновременно происходит восстановление коферментов НАД и ФАД. Для непрерывного и полного биологического окисления эти кофермеи - ты должны окисляться вновь. Окисление осуществляется совокупностью переносчиков электронов, образующих цепь переноса электронов (ЦПЭ), фиксированную в митохондриях. ЦПЭ обеспечивает следующие реакции:
З НАД-Н + 1,5 02 + ЗН+ з НАД+ + 3 Н20 - 3 • 52,4 ккал/моль,
(ФАД-Н) + 0,5 О, —► (ФАД) + Н20 — 36,2 ккал/моль.
Реакция ацетил-КоА имеет вид
CH3COS - КоА + 2 02 -> 2 С02 + Н20 + КоА - SH - 215,2 ккал/моль.
ЦПЭ, иначе именуемая дыхательной цепью, представляет собой
Углеводы-*- CH-CDC07 п
3 2 0 S-KoA
Кислоты
ПируВат у Жирные
KQA-SH-»\ СН
К. 3 >
У v4*- 'Ацетил-КоК С02 2Н ■
А.
^ с=о (Т) г«
KoA-SH
Фн Сущинил-Ш KoA_SH Рис. 6.4. Цикл Кребса.
'2
Тре-'ЪА.-изоцитрац
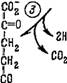
2
А-кетоглутарапі
Щ їо! аКу
НО-СН С02 fiOj (2)
' СН2 Оксалацетат Цитрат
FQ) l-тлат \ Vz
Полиферментную систему, акцептирующую электроны из цикла Кребса и цикла окисления жирных кислот.
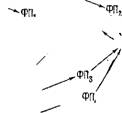
Электрон переносится по следующей цепи [1, 2, 4]: Сукцинат —► ФП3 1
Субстрат —*■ НАД —»- ФП0 —>■ Цитохром Ь —>- —*■ Цитохром С) —»• Цитохром с —»- Цитохромы а + аз —*■ 02.
Флавопротеиды — специфические ферменты, содержащие флави- новые коферменты—ФАД (см. рис. 6.3) и флавинмононуклео - тид ФМН, рибофлавин-5'-фосфат. Цитохромы содержат группу гема, атом железа которого при работе цепи подвергается окислению и восстановлению:
Fe2+ Fe3+ - f e~.
Перенос электронов в приведенной цепи происходит слева направо, завершаясь восстановлением кислорода, который соединяется с водородом и образует воду. Освобождаемый при окислении электрон соединяется со следующим звеном цепи. Перенос электронов сопровождается изменением свободной энергии, так как электроны перемещаются по каскаду возрастающих окислительно-восстановительных потенциалов. Их значения приведены в табл. 6.1 [1].
Таблица 6.1
Окислительно-восстановительные потенциалы некоторых систем
|
Система |
Ф, в |
Система |
Ip. В |
|
Н2о/'/ао2 Цит a Fe2+/Fe3+ Цит с Fe2+/Fe3+ Цит с, Fe2+/Fe8+ Цит Ь Fe2+/Fe3+ С у кци нат/фу ма рат Г лу та мЭт/а- кетоглута par |
0,82 0,29 0,23 0,21 0,05 —0,03 —0,14 |
Восстановленный флавнн/фла - вин Лактат/пируват НАД-Н/НАД Малат/пируват «/ан2/н Ацетальдегид/ацетат |
-0,188 -0,19 -0,32 -0,33 -0,42 -0,00 |
Перенос электронов по дыхательной цепи сопряжен с запасанием энергии в макроэргических молекулах АТФ. Иными словами, освобождаемая свободная энергия конвертируется в химическую энергию АТФ. Происходит окислительное фосфорили - рование.
Это важнейшее явление было впервые открыто Энгельгард - том в 1930 г. [5]. Белицер и Цыбакова [6] подробно изучили стехиометрические соотношения между окислением и фосфори - лированием, провели первые определения коэффициента Фн О. т. е. отношения числа молекул этерифицированного неорганиче
ского фосфата к числу атомов поглощенного кислорода, и показали, что значение этого коэффициента не менее 2. В работе [6] были даны термодинамические оценки, показавшие, что энергия переноса электронов на кислород достаточна для образования двух или большего числа молекул АТФ на один атом поглощенного кислорода. Калькар установил, что аэробное фосфо - рилирование сопряжено с дыханием и не зависит от гликолити - ческого фосфорилирования [7]. Количественные соотношения были уточнены Очоа [8]. Коэффициент Фн: О для окислительных реакций цикла Кребса и реакций с участием НАД равен 3. Ленинджер впервые установил, что процессы окислительного фосфорилирования локализованы именно в митохондриях [4, 9,
АТФ \ АТФ АТФ
НАД—ФП,—KoQ—>-^/77 Ь-~-цит ь-^-цит с—-цит - 02 Глутамат ' 1
З-онсиацил-У&к
КоА - произВодное жирной кислоты
Глицеродюс/рат
Рис. 6.5. Дыхательная цепь [1,2].
Прямые стрелки показывают места вхождения электронов. ФП,. ФП,, ...—флавопротеиды.
KoQ — кофермент Q.
10], и в работах его лаборатории были найдены узловые пункты дыхательной цепи, в которых происходит фосфорилирование. Указанное значение Фн : О следует из уравнения
НАД-Н + Н+ + З АДФ + 3 Ф„ + V2O2 —► НАД+ + 4 Н20 + 3 АТФ. В этом уравнении суммируются экзергоническая реакция НАД-Н + Н+ + V2O2 —> НАД+ + Н20 + 52,7 ккал/моль
И эндергоническая реакция
3 АДФ + 3 Фн —>■ З АТФ + 3 Н20 — 21,9 ккал/моль.
Фосфорилирование АДФ -> АТФ происходит в трех узловых пунктах — в участке цепи НАД-Н —► флавопротеид, в участке цитохром Ь цитохром сі и в участке цитохром с -* цитохромы а + а3.
Общая схема сопряжения окисления с фосфорилированием приведена на рис. 6.5.
Напишем вновь брутто-уравнение фосфорилирования
ПируВат^ Сущинагп
АДФ + H2P04" - f Н+ +=± АТФ + HgO — ДО,
Где AG — изменение свободной энергии. Имеем
TOC \o "1-3" \h \z [адф] Гн, ро:1 [н+] , >4
AG = AG" + RT ІП. (6.1)
AG0 — стандартное изменение свободной энергии в калориях, т. е. значение AG при рН 7,0, 25°С и концентрациях всех компонентов, равных 1,0 М. Как известно,
AG0 = - RT In К, (6.2)
где К — константа равновесия реакции. Для фосфорилирования AG0 = 7,3 ккал/моль. Наблюдаемое значение AG in vivo зависит от концентрации протонов по обе стороны мембраны и, следовательно, от мембранной разности потенциалов. AG зависит также от концентрации ионов Mg++. При изменении рН от 6,0 до 9,0 при [Mg++] = 10 мМ AG меняется от 6,17 до 9,29 ккал/моль (см. [79, 113]).
Изменение свободной энергии при переносе двух электронных эквивалентов по ЦПЭ от НАД-Н к 02 определяется разностью окислительно-восстановительных потенциалов 0,82 — (—0,32) = = 1,14 В, т. е.
AG0 = z Д-ф = — 2 • 23,06 -1,14 ккал/моль = — 52,7 ккал/моль.
Это обеспечивает с избытком синтез 3 молей АТФ из АДФ и Фн. Эффективность процесса выражается величиной 21,9/52,7, т. е. примерно равна 40%.
Энергетический смысл дыхания состоит в синтезе АТФ. Энергия, аккумулированная в АТФ, используется клеткой для выполнения всех видов ее работы.
Раскрытие химизма биологического окисления — крупнейшее достижение биохимии. Здесь изложены лишь некоторые важнейшие сведения, подробное рассмотрение сложной биохимической системы окисления содержится в специальной литературе (см. [1—3, 11—13]).
Особенность системы окислительного фосфорилирования, отличающая ее от ряда ферментативных реакций, протекающих в растворе, состоит в строгой пространственной локализации звеньев многоступенчатого процесса. Окислительное фосфорилиро - вание локализовано в митохондриях и непосредственно связано с транспортной и механохимической функциональностью их мембран. По-видимому, столь сложная система биохимических реакций принципиально требует пространственной неоднородности и не могла бы реализоваться в гомогенной среде.
Расшифровка кратко описанных здесь окислительно-восстановительных реакций была получена в результате применения тонких химических и физических методов. Здесь, в частности,
сыграли большую роль работы Чаиса, посвященные спектроскопии переносчиков электронов (НАД, ФП, цитохромов) в интакт - ных митохондриях. Эти переносчики обладают характерными полосами поглощения в видимой и близкой ультрафиолетовой областях спектра, и разностные спектры позволяют изучать кинетику их окисления и восстановления [14]. Были применены различные способы удаления из митохондрий специфических ферментов н. тем самым, сохранения лишь определенных звеньев
НАД-Н
(Fe-Fe)
\
KoQ \
І—(FB-FBV і
Ж
ПІ
KoQ ♦
(Fe-Fe) II t
Ш
Сутщншп
Рис. 6.6. Распределение белков по комплексам ЦПЭ І, II, III, IV.
А, Ь, с. Сі, йі— >нтохромы, Си — медьсодержащие белкн, (Fe —be) —негемнновое железо, fs — сукцинатдегидрогеназа, iq—НАД Н-дегидрогеназа.
Процесса. Митохондрии подвергались расчленению, из субмито- хондриальных частиц выделялись комплексы дыхательных ферментов, свободные от структурных белков. Такие комплексы оказалось возможным очищать и детально исследовать. Были проведены успешные опыты по восстановлению ЦПЭ из выделенных препаратов и растворимых ферментов. Наконец, очень ценная информация была получена в опытах по ингибированию отдельных стадий процесса и по разобщению окислительного фосфорилирования и переноса электронов (см. § 6.5).
Можно считать установленным, что переносчики ЦПЭ сгруппированы в четыре комплекса, именуемые комплексами Грина (см. [15]). Соответствующая схема приведена на рис. 6.6. Молекулярный вес каждого комплекса равен примерно 3-Ю5 Он содержит около 64% белка и 36% липидов. Электрон-переносящий
комплекс определяется как минимальная единица ЦПЭ, сохраняющая способность переносить электрон со скоростью, сравнимой с этой скоростью в интактных митохондриях.
Изучение биологического окисления встречается с необходимостью решения ряда физических проблем, относящихся к различным уровням организации и функционирования системы.
Структура и функции молекулярных переносчиков электронов изучены еще недостаточно. В § 6.7 рассмотрены современные данные, относящиеся к строению и свойствам цитохрома с. Цитохром с исследовался очень детально, но его динамические свойства нельзя считать полностью установленными и объясненными.
Строение и функциональная организация митохондрий явились предметом интенсивного изучения. Тем не менее, многие важнейшие вопросы, сюда относящиеся, пока не имеют ответа. Специфическая мембранная структура мигохондрий, присутствие в них автономной программы синтеза белков (ДНК), механохи - мическая активность митохондрий непосредственно связаны с их ролью «силовых станций» клетки. Дальнейшее развитие физики митохондрий требует целостного подхода.
Общая теория электронного транспорта в локализованной системе биологического окисления интенсивно развивается. Предложены содержательные кинетические модели, начаты теоретические исследования, основанные на рассмотрении элект - ронно-конформационных взаимодействий. Эти проблемы представляют первостепенный интерес для биофизики.
Необходимо установить молекулярную природу биологического окисления, осуществляемого в результате сопряжения ферментативных, транспортных и механохимических процессов. Митохондрия есть место интегрирования широкой совокупности мо - лекулярно-биологических явлений, целостная система, требующая всестороннего изучения — теоретической и экспериментальной разборки и сборки «черного ящика».