Электронный Парамагнитный резонанс в биологии
Механизм образования вторичных радикалов
|
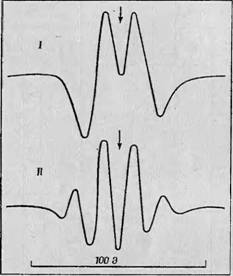
Фиг. 59. Различные типы спектров, наблюдаемые на белках, подвергнутых рентгеновскому облучению [9]. I — одиночный дублет, обусловленный взаимодействием с CH-группой в радикалах типа II (полиглицнн); II—квартетная сверхтонкая структура, обусловленная взаимодействием с СП-группой в радикалах типа III (поли-г-алашш). |
Экспериментальные данные, коротко изложенные выше, свидетельствуют о том, что радикалы, обнаруживаемые методом ЭПР в биологических тканях, подвергнутых жесткому облучению,
и большинстве случаев представляют собой совсем не те первичные радикалы, которые образуются непосредственно под действием излучения. В связи с этим возникает интересная проблема, касающаяся механизма образования вторичных свободных радикалов из первичных продуктов облучения.
Горди и сотр. [17, 20] предположили, что этот механизм основан на внутримолекулярной миграции электронов. По их мнению, в веществе, подвергнутом действию ионизирующего излучения, на первом этапе происходит неупорядоченное образование элект-
|
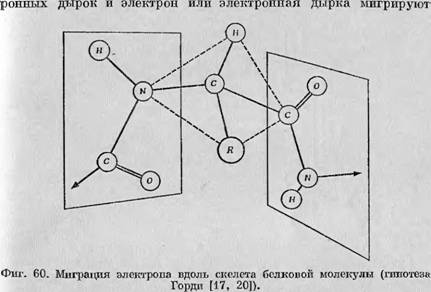
Электрон или электронная дырка мигрируют от одной пептидной группы к другой через, асимметричный атом углерода путем сверхсопряжения. |
По белковой молекуле к серусодержащим группам и остаткам глицина, где в результате отрыва атома водорода и происходит образование вторичных радикалов. Поскольку такого рода процесс предполагает исключительно легкое и быстрое движение электрона или дырки вдоль белковой молекулы, было предположено, что волновые функции пептидных групп перекрываются через асимметричный атом углерода. Этот механизм изображен на фиг". 60, где показана ориентация плоскостей пептидных групп, и можно наглядно представить себе, как может происходить перекрывание волновых функций через промежуточный атом углерода.
Другой механизм (в какой-то степени схожий с механизмом Горди), который также позволяет объяснить высокую подвижность электронов, был предложен Блюменфельдом и Калмансоном [21].
Выдвигая свою гипотезу, авторы исходили из своих ранних работ, в которых было показано, что при одинаковой дозе облучения белковая молекула получает меньшее радиационное повреждение, чем входящие в ее состав аминокислоты. Поэтому авторы предположили, что в белковой молекуле существует система полос проводимости, возникающая в результате взаимодействш. меяеду
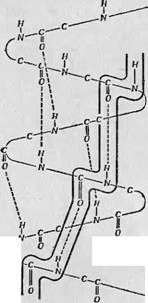
Соседними витками спиральной полипептидной цепи. Такой возможный канал проводимости показан на фиг. 61; электронные волновые функции соседних витков спирали перекрываются через посредство водородных связей, и таким образом создается прямой и быстрый путь для движения электронов вдоль скелета белковой молекулы. Проведенное в дальнейшем более тщательное сравнение числа центров поражения в белках и в составляющих их аминокислотах показало, однако, что статистически значимого различия между этими числами нет, а следовательно, отпадает необходимость в таком канале быстрой проводимости электронов вдоль белковой молекулы. Сейчас, по-види-
СМому, ужеЛгет нужды в этом первоначальном варианте механизма радиационной защиты, основанном на существовании в белках полос проводимости, однако возможность самого их существования является интересным предпо - ложегшем, которое будет либо подтверждено, либо отвергнуто в будущих экспериментах.
|
Фиг. 61. Миграция Электронов через систему полос Npoi цимостн (гипотеза Блюмепфельда и Калман- Сон< [21]). В белке возникают системы tni® ',Лос проводимости за счет обр;Н| зовачий водородных связей. |
В качестве! альтернативы к этим двум механизмам, объясняющим образование вторичных радикалов миграцией электронов, Хенриксен [15, 22] предположил, что вторичные свободные радикалы образуются е результате прямого взаимодействия с фрагментами молекулы, а не в результате миграции электрона. По его мнению, первичные центры, не обнаруживаемые методом ЭПР,' представляют собой смесь положительных и отрицательных ионов, возникших, под действием ионизирующего излучения, а также радикальных фрагментов, образовавшихся в результате разрыва химических связей. Эти первичные радикалы реагируют друг с другом и с соседними неповрежденными молекулами, что и при
водит к образованию вторичных белковых радикалов. Таким образом, здесь в отличие от обсуждавшихся выше внутримолекулярных процессов предполагается межмолекулярный процесс. На первый взгляд представляется затруднительным выбрать такую программу эксперимента, которая позволила бы отдать предпочтение какому-либо из этих механизмов. Но если образование вторичных радикалов действительно обусловлено взаимодействием между молекулярными фрагментами и неповрежденными молекулами, а не миграцией электрона внутри данной молекулы, то это можно продемонстрировать, добавляя в изучаемую систему некоторые специфические молекулы и наблюдая, атакуются ли они в процессе образования свободных радикалов.
Такой метод и был применен Хенриксеном и его сотрудниками. Они исследовали спектры ЭПР первичных и вторичных радикалов, полученных при рентгеновском облучении смеси определенных белков с соединениями меньшего молекулярного веса. Эти смеси сначала облучали при 77 К и в этих же условиях (без нагревания до комнатной температуры) записывали спектры ЭПР. Как и следовало ожидать, вид спектров показал, что и белковые молекулы и добавленные низкомолекулярные соединения повреждаются облучением и в них появляются свободнорадикальные центры. Поскольку полученные спектры были в точности такими же, что и спектры белков, облученных в отсутствие примесей, можно было сделать вывод, что добавление низкомолекулярного вещества не производит никакого заметного действия на первичные радикалы, образовавшиеся в белках. Но когда затем эти смеси нагревали до комнатной температуры (что давало возможность первичным радикалам реагировать друг с другом и с остальными молекулами) и снова записывали спектр ЭПР, становилось очевидным, что неспаренные электроны, первоначально возникшие в белках под действием облучения, переходят на добавленные в смесь компоненты. К тому же выводу привели и опыты с мечеными атомами серы. Эти эксперименты весьма убедительно доказывают, что образование по крайней мере некоторых вторичных радикалов основано на межмолекулярном механизме, т. е. на реакциях обломков молекул друг с другом. Но, конечно, не исключено, что какая-то часть вторичных радикалов образуется все же в результате внутримолекулярной миграции электронов по самим белковым молекулам.