Электронный Парамагнитный резонанс в биологии
[Исследование процессое, релаксации в бгюлогическиж молекулах
Как указывалось в начале книги, и в частности в разд. 3.7, для того чтобы неспаренный электрон, поглотивший энергию в процессе ЭПР-перехода, мог вернуться в основное состояние, в молекуле, которой принадлежит этот электрон, должны иметь место процессы релаксации. Именно эти процессы делают возможным непрерывное поглощение подаваемого на образец микроволнового излучения и обеспечивают постоянство сигнала ЭПР. Но при очень большой мощности падающего излучения электроны не успевают вернуться на основной уровень достаточно быстро, и тогда наступает состояние, называемое «насыщением». В уравнение (3.11), описывающее насыщение, входят два основных параметра — время спин решеточной релаксации 7 (обычно это как раз та константа, которая подлежит опредЖению) и напряженность микроволнового поля Н. Падающую микроволновую мощность и, следовательно, Н увеличивают до тех пор, пока не достигается достаточно хорошо выраженное насыщение; его можно измерить и на основании полученных результатов определить истинное значение TL из уравнения (3.11).
Очевидно, что такого рода измерения можно провести с помощью стандартного ЭПР-спектрометра; сверх того нужен лишь источник мощного микроволнового излучения, а также устройство, позволяющее одновременно {контролировать и интенсивность, и ширину линии поглощения. Соответствующее! экспериментальное оборудование уж Л рассматривалось подробно в разд. 3.8; на фиг. 44 была приведена блок-схема спектрометра, специально сконструированного для измерения времени релаксации, а на фиг. 45 показана картина затухания типичного сигнала ЭПР после подачи на образец мощного микроволнового импульса, генерируемого в этом спектрометре. В этом разделе мы рассмотрим конкретные результаты, получаемые при исследовании биологических соединений этим методом, и обсудим смысл этих результатов. Хорошим примером того, каким образом на основании данных о релаксации можно дифференцировать различные компоненты спектра ЭПЩЯможет служить исследование альдегидокси дазы, в частности исследование входящих в ее состав ионов молиб дена. Алъдегидоксидаза может быть выделена из печени кролика, и ее структура и свойства [1] очень похожи на структуру ;и свойства ксантиноксидазы, которую мы достаточно подробно обсуждали в гл. 5. Молекулярный вес альдегидоксидазы равен 280 ООО. В ее состав, как и в состав ксантиноксидазы, входят молибд i и железо (2 атома молибдена и 8 атомов железа на молекулу) 12].
Вспомним, что Mo(V) в рссантиноксидазе дает сигнал ЭПР с характерным значением G фактора 1,97; такой же:сигнал обнаружен и в спектре альдегидоксидазы. Он наблюдается в препарате фермента, находящегося в состоянии «покоя», и соответствует его окисленному состоянию. Сигнал обладает сверхтонкой структурой из шести линий, характерной для изотопов Мо95 и Мо91, и, следовательно, несомненно обязан своим происхождением атомам молибдена. Каж уже упоминалось раньше, [ количество Mo(V) в таком «покоящемся» ферменте составляет около 25% общего количества Mo(V), обнаруживаемого методом ЭПР в актив ном ферменте. Поэтому казалось бы, что очень трудно отличить молибден, принимающий активное участие в ферментативном процессе; от молибдена, присутствующего в «покоящемся» ферменте, так как их сигналы должны накладываться один на другой. Однако было обнаружено [3], что сигнал Mo(V), возникающий при восстановлении альдегидоксидазы в процессе катализа, характеризуется меньшим временем релаксации, чем соответствующий сигнал «покоящегося» фермента. Это дает возможность точно определить соотношение этих двух сигналов, регистрируя изменения суммарного времени релаксации по мере возрастания ферментативной активности. И действительно, экспериментально было показано [4], что с повышением активности альдегидоксидазы время релаксации сигнала Mo(V) уменьшается. Тем самым было продемонстрировано, что разделение сигналов ЭПР на основании данных о времени релаксации вполне осуществимо на практике.
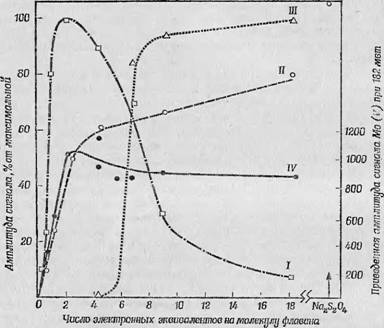
Разделение двух видов Mo(V), содержащихся в альдегидокси - дазе, было использовано также для изучения кинетики переноса электронов на начальных стадиях ферментативной активности 14, 30]. Титрование фермента малыми количествами субстрата в анаэробных условиях показало, что на начальных стадиях такого титрования восстанавливающие эквиваленты поступают лишь на флавин - и железосодержащие компоненты фермента, тогда как сигнал Mo(V) «покоящегося» фермента изменяется крайне незначительно. Максимум сигнала ЭПР, обусловленного свободными радикалами, наблюдается в тот момент, когда на молекулу флавина приходится около трех электронных эквивалентов; к этому моменту интенсивность сигнала железа с,^-фактором, равным 1,94, достигает примерно половины максимального значения. И только после добавления шести электронных эквивалентов на каждую молекулу флавина обнаруживается резкое изменение времени релаксации сигнала Mo(V), свидетельствующее о появлении характерной молибденовой компоненты, непосредственно связанной с ферментативной активностью. Все эти превращения изображены на фиг. 115, где по оси ординат отложены амплитуды сигналов ЭПР, выраженные в процентах от максимального значения амплитуды сигнала данного типа. Для сигналов молибдена вводится поправка, учитывающая сигнал, обнаруживаемый в состоянии покоя. Кривые I—III получены при микроволновой мощности около 0,5 мвт (левая ось ординат), а кривая IV — при микроволновой мощности 182 мВт (правая ось ординат). Можно видеть, что кривые III и IV имеют совершенно разную форму и, следовательно, времена релаксации для двух типов Mo(V) сильно отличаются друг от друга.
По мнению Байнерта и Орме-Джонсона [4], результаты этих экспериментов мояшо объяснить тем, что в процессе катализа содержащийся в ферменте молибден все сильнее взаимодействует с парамагнитными центрами, возникающими в непосредственной близости от него,— со свободными радикалами семихинона фла - вина и железосодержащим компонентом, соответствующим G = 1,94. Максимальной взаимодействий'] наблюдается ДЛЯ тот момент, Когда количество семихинона достигает максимума, постоянство же величины молибденового сигнала, наблюдаемое после |гого, как свободнорадикальный сигнал семихинона начинает - уменьшаться, объясняемся тем, что одновременно растет? сигнал «нЯзлеза G — 1,94, что н^к'омпенсирует падение сигнала
|
Фиг. 115. здщммка алъдегидоксидавнта юеашщи.'ДЗО]. Кривые. I, II и J/rjL интенсивность'1 ciirjjijjioB ЭПР fв (ЮоджиЯрданчаЯов, железу и; 1илибдспа«соотве*ствснна['в усло^шх. щк^да^падающа»,^ образец Нишроволноыя мощность составляет 0,5 мвтЬжртзая, IV. иллюстрирует насыщение ^смивденовоЙ^нШ ™,инал!51 при '.йЯжтоввлновой* мощности 1КЯ мвт См. текста I |
Семихинона. В результате тщательного исследования кин^тикёт ^изменения времен релаксации удалось получить белеР точные сведщшя относительно взаимодействий между различными парамагнитными центрами этого фермента. Дальнейшие подробности, касающиеся этих экспериментов, читато'лт^может найти в обзор - нЙМстатье Байнерта и Орме-Джонсона [4].
Мы рассмотрели эти эксперименты с целью показать, ткаким образом исследование насыщения дает возможность дифференцировать различные парамагнитные центры в активном ферменте Очевидно, что этот метод, позволяющий дифференцировать ионы металлов, найдет широкое применение в области биохимии. Но явление насыщения и измерение времени релаксации, можно также использовать для исследования конкретных взаимодействий, происходящих внутри самой молекулы. Примером такого рода служит работа Байнерта и Хеммериха [5], в которой изучалось действие добавленных ионов никеля на различные флавино - вые производные. Более ранняя работа Хеммериха [6] на свободных семихинонах флавина показала, что они образуют более стабильные хелатные комплексы с металлами, находящимися в четвертом
|
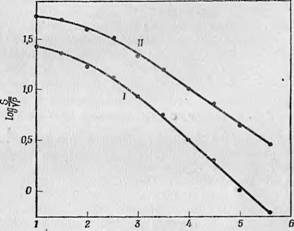
Log Р Фиг. 116. Влияние ионов никеля на насыщение ЭПР-поглощения семихинона' Диметилбеизиллюмифлавина [7]. Кривая 1 построена для полученного электрохимическим отчислением семихинона люми - флавпиа в отсутствие ионов никеля, кривая II — в присутствии 5 ■ Ю-2 М раствора №С12, добавленного после оштеления. Символ S означает амплитуду сигнала ЭПР, Р — микроволновую мощность в микроваттах. |
И пятом координационных положениях, чем окисленные или полностью восстановленные флавины. Было также обнаружено, что комплексы семихинонов флавинов с парамагнитными, металлами не дают сигналов ЭПР и, следовательно, либо диамагнитны, либо сигналы их настолько уширены, что их нельзя обнаружить.
Дальнейшие исследования этих реакций [7] показали, однако, что если окисление таких производных флавина, как 5-бензил- 1,3-диметиллейколюмифлавин, производить быстро, чтобы избежать разложения флавина (это можно контролировать спектро- фотометрически), то добавление ионов никеля приводит к увеличению времени релаксации, как и в случае незаблокированных флавинов. Пример такого рода приведен на фиг. 116, где показано,
Как изменяется насыщение ЭПР-поглощения семихинона люми - флавина при. добавлении, ионов никеля.
Исследования таких блокированных флавинов в других средах 17] привели, к предположению, что взаимодействие флавинов с металлами, происходит не с образованием хелатных комплексов, а по какому-то другому пти. Один из возможных механизмов такого взаимодействия — образование «мостикового комплекса», в котором анион служит промежуточным звеном между катионом семихинона флавина и парамагнитным ионом металла. Этот ком - плексообразующий анион может обеспечивать релаксацию между флавином и. парамагнитным металлом. Хотя для точного выясне-М ния природы таких взаимодействий необходимо, конечно, ещеН многое сделать, приведенные данные ясно показывают, что эксперименты по исследованию насыщения и. измерению времен релаксации. чрезвычайно перспективны и. обещают дать интереснейшую информацию о тонких взаимодействиях между ионами металлов и. окружающими их группами в б и о л о г и ч е с к их молекулах.