Добавки в бетон Справочное пособие
ВЛИЯНИЕ ХЛОРИДА КАЛЬЦИЯ НА ГИДРАТАЦИЮ КЛИНКЕРНЫХ МИНЕРАЛОВ
2.2.1. Трехкальциевый силикат. Поскольку ускоряющее действие хлорида кальция на цемент объясняют в основном его влиянием на C3S, важно понять, в чем оно заключается. Иногда его объясняют сочетанием Са2+—С]-, так как по ускоряющему гидратацию C3S действию катионы располагаются в ряд: Са2+> Sr2+>
> Ва2+> Li+> Na + > К+- Что касается аниона, то хлорид-ион уступает сульфат-иону, а в целом анионы располагаются в ряд: S02-> ОН~>
> С1~> Вг~> I > N03"> >СН3СОО" [6—8]. Хлорид кальция не только изменяет степень гидратации C3S, но и способен взаимодействовать с ним и с его гидратными новообразованиями, а также влиять на такие свіойства этих последних, как прочность, химический состав, удельная поверхность, морфология и поровая структура.
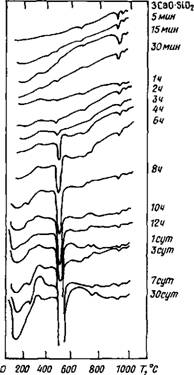
■ 2.2.1.1. Гидратация. Будучи важнейшими фазами портландцемента, C3S и C2S в существенной степени определяют прочность цементных материалов. По данным [9—41], введение хлорида кальция ускоряет гидратацию C3S, в частности, благодаря сокращению индукционного периода, что может быть оценено, как и для других составляющих клинкера (при исследовании степени их превращения в разные сроки), по количеству Са(ОН)2, потере при прокаливании, тепловыделению, данным кондуктометрии и т. д. Для этой цели использован метод дифференциального термического анализа (ДТА) [7, 11, 13, 14, 16, 24, 28, 33, 42]. Типичные результаты представлены на рис. 2.1 и 2.2 [4, 13] и свидетельствуют о возможности с помощью ДТА оценить влияние хлорида кальция. Для безводного C3S характерны эндотермические эффекты при 680, 930 и 970—980° С. Начало гидратации C3S фиксируется по эндотермическому эффекту при 300° С, что связывают с образованием геля C-S-H; его возрастание свидетельствует об увеличении количества C-S-H - фазы. Очень слабый эндотермический эффект при 480° С, появляющийся через несколько минут и четко фиксируемый через 1 ч, можно отнести к дегидратации Са(ОН)г. В течение первых восьми часов на долю Са(ОН)2 приходится около 25 % всего гидроксида кальция, образующегося по истечении 30 сут.
В присутствии 1 % хлорида кальция с помощью ДТА удается обнаружить существенные различия в кинетике гидратации C3S: эндотермические эффекты при температуре менее 300° С становятся заметно выше; более интенсивны также эффекты, присущие гидроксиду кальция; к 5 сут их содержание по сравнению с таковым к 30 сут возросло до 33 %, через 2 ч появился новый эндотермический эффект при 550° С, отсутствовавший при гидратации C3S без добавки. Наконец,
через 4 ч появился экзотермический пик при 690° С, за которым обычно следует эндотермический эффект при 800— 840° С. Все это может свидетельствовать об ускоряющем действии хлорида кальция на гидратацию C3S и о возможности его хемосорбции на поверхности C-S-H, а также, по-видимому, о внедрении некоторого количества хлорид-ионов в решетку гидросиликатов [14].
|
Рис. 2.1. Скорость гидратации ЗСаО - •Si02, определенная методом ДТА |
В присутствии 4 % хлорида кальция некоторые из термических эффектов стали интенсивнее в более ранние сроки, чем при введении 1 % этой добавки. Появление эндотермического эффекта при 570—590° С можно связать с образованием поверхностных комплексов между хлоридом кальция и продуктами гидратации C3S. Больший эндотермический эффект при 810—850° С наблюдался и в период 3 ч — 30 сут гидратации в системе C3S + + 4 % СаС12.
|
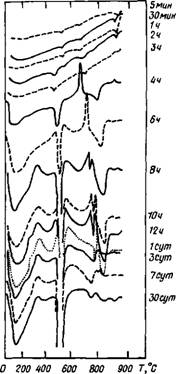
Рис. 2.2. Скорость гидратации C3S в присутствии 1 % СаСЬ, определенная методом ДТА |
Через 30 сут по степени гидратации эти системы можно расположить в ряд: C3S + 4 %
CaCl2> C3S-I-1 %СаС12> C3S, а по содержанию Са(ОН)г—в другой ряд: C3S + 1 %СаС12> >C3S>C3S+4 %СаС12.
Аномалия может быть объяснена более высокой основностью гидросиликатов, образующихся при введении 4 % хлорида кальция в C3S. Добавление к C3S 2 % СаСЬ во все сроки — вплоть до одного месяца — увеличивает количество образующегося C-S-H [4, 20] (рис. 2.3).
Ускоряющее действие хлорида кальция на гидратацию C3S сохраняется и при повышенной температуре, причем проявляется в большей мере в раннем периоде. Так, к 24 ч степень гидратации C3S без добавки составила 30 и 60 % при температуре соответственно 22 и 80° С, а при введении 2 % хлорида кальция для этих же температур и сроков — 60 и 70% [25].
На термокинетических кривых вид но, что добавление 2 % хлорида кальция к C3S при 25, 35 и 45 °С не только интенсифицировало общее тепловыделение на ранней стадии гидратации C3S, но и сократило время появления пика, отвечающего максимуму тепловыделения [41].
Разница в гидратации C3S в присутствии хлорида кальция прослеживается и в условиях автоклавной обработки проб при 190° С в течение 5 ч — после их хранения до этого при нормальной температуре в течение разных сроков.
В присутствии 2 % СаСЬ
|
Рис. 2.3. Зависимость степени гидратации C3S от содержания СаС12 |
|
Рис. 2.4. Зависимость скорости тепловыделения v при гидратации C3S от содержания СаС12 |
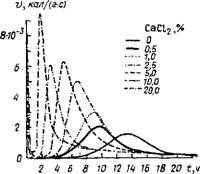
Гидратация C3S в автоклаве оказалась сильно заторможенной, что можно объяснить замедлением образования а - C2SH и C3SHi,5. Ускоряющее действие хлорида кальция прослеживается при значении В/Т=10 при введении добавки в концентрации 0,72N: при этом степень гидратации C3S через 20 ч возрастает вдвое по сравнению с эталоном C3S без добавки [17]. По данным [4, 23], при увеличении дозы хлорида кальция до 20 % к C3S сокращается не только время до появления пика на калориметрической кривой, но и снижается его высота (рис. 2.4).
Введение хлорида кальция изменяет как степень гидратации C3S, так и химический состав гидросиликатов. Отношение C/S зависит от начального водотвердого отношения и степени гидратации. По данным [18, 241, введение 2% СаС12 приводит к снижению основности гидросиликатов (хотя в этих работах отношение C/S различно); по данным [15], при степени гидратации C3S до 30 % введение 2 % СаСЬ уменьшает C/S, а при большей степени гидратации увеличивает C/S по сравнению с эталоном. Добавление 5 % хлорида кальция в еще большей степени увеличивает отношение C/S (при 2 % СаСЬ оно составляло 2) [15]. Вообще считается, что с увеличением дозировки СаСЬ от 0,5 до 5 % отношение C/S возрастает [27], что не согласуется с предыдущими работами. В „недавнем исследовании [44] с введением 2 % СаСІг к C3S было обнаружено, что в индукционном периоде отношение C/S в присутствии добавки понижается, а в дальнейшем почти не отличается от C/S эталона. При гидратации C3S в шаровой мельнице введение хлорида кальция существенно снижает отношение C/S в течение нескольких часов [18]. Хлорид кальция влияет также на отношение H/S в C-S-H [27].
Введение индивидуальных добавок—сульфатов и хлоридов — повышает степень гидратации C2S, а их комбинация может вызвать дополнительное ускорение этого процесса [25]. Соответственно сокращаются и сроки схватывания C3S. В смеси C3S + C2S без добавки, а также с 0,1 и 2 % СаСЬ время до начала схватывания составило соответственно 790, 525 и 105 мин [14].
2.2.1.2. Механизм гидратации. В ранних работах [45— 48] ускоряющее действие хлорида кальция связывали с образованием гидроксихлорида кальция. В системе СаО-|- Ч-СаСІг + НгО известны две эти соли: ЗСаО-СаСЬ• І6Н2О и Са0-СаСІ2-2Н20; первая стабильна при концентрации хлорида кальция 18 % и более, и вторая — при концентрации 34 % и более [14]. Однако такую дозу хлорида кальция в обычных условиях не вводят, поэтому не реализуется и этот механизм (за исключением, возможно, низкого водотвердого отношения [33] ).
Известна также гипотеза каталитического действия СаС12 на C3S [19, 39, 47, 49, 50, 55, 56], хотя точный механизм этого эффекта недостаточно ясен. Авторы гипотезы исходят из того, что хлорид кальция не реагирует с C3S и продуктами его гидратации. Однако имеются данные, свидетельствующие о способности СаСІ2 реагировать с новообразованиями, возникающими при гидратации C3S, которые при вымывании водой оказываются нестабильными. В работе [16] исходят именно из этой концепции. Принимается, что хлориды могут быть в свободном состоянии в виде поверхностных комплексов с C-S - ЬГ-фазой в индукционном периоде, в хемосорбированном состоянии на поверхности C-S-H, в межплоскостных пространствах и в решетке C-S-H. В период ускорения адсорбция хлорид-ионов может оказать автокаталитическое действие, в том числе на возникающие центры кристаллизации.
Увеличение поверхности и модифицирование морфологии гидратных фаз в присутствии СаСЬ может быть связано с хемосорбцией хлорид-ионов в межслоевых прослойках, а торможение образования афвилл'и- та при гидратации C3S — с внедрением хлорид-ионов в решетку C-S-H.
Согласно [6], ускоряющее действие хлорида кальция заключается в том, что способ - ключается в том, что он способствует образованию первичных нестабильных гидросиликатов кальция, сокращающих время формирования зародышей новой фазы и приводящих к образованию более пористых структур. Это объяснение основывается на том факте, что добавление СаСЬ к C3S на стадии предгидратации не ускоряет его последующую гидратацию.
Введение хлорида кальция снижает щелочность жидкой фазы гидратирующегося C3S; в отсутствие СаСЬ гидратиро - вавшийся в течение 1, 2, 3 и 4 ч C3S имел рН соответственно 12,31; 12,38; 12,41 и 12,43, тогда как за те же сроки в присутствии хлорида кальция рН составляло 11,67; 11,77; 11,85 и 11,9 [24]. Это снижение рН может быть компенсировано ускорением гидратации C3S. Таким образом, изложенный фактор может влиять на ускоряющий эффект СаСЬ. Кроме того, возможно, что хлорид кальция играет определенную роль, ускоряя начальные реакции конденсации, протекающие при гидратации C3S [37], способствуя тем самым росту степени гидратации и прочности цементного камня.
Имеются данные, что в ряду катионов большим ускоряющим действием обладают те из них, которые имеют меньший ионный радиус [6]. Некоторые исследователи в связи с этим утверждают, что на механизм ускоряющего действия добавок оказывает влияние их диффузия [41].
Авторы исследования [51] предполагают, что механизм действия хлорид-ионов заключается в их диффузии через слой первично образованных гидросиликатов в зону реакции, а это убыстряет обратную диффузию ОН~-ионов. В результате может ускориться выделение Са (ОН) 2, что приведет к нарушению состава гидросиликатов кальция, находящихся во внешней зоне.
Таким образом, нельзя предложить простой механизм действия хлорида кальция на кинетику гидратации C3S, который сводил бы ускоряющий эффект этой добавки только к какому - либо одному фактору. Наиболее вероятен сложный механизм, сочетающий в себе различные аспекты действия СаС12 в зависимости от условий эксперимента и времени.
2.2.1.3. Микроструктура. Существуют разные точки зрения по этому вопросу. Согласно [52], при гидратации C3S гидросиликаты, имеющие в отсутствие добавок сигарообразную форму размером 0,25— 1 мкм, приобретают в присутствии СаС12 ф^рму сферолитов. Данные [24] совпадают в целом с предыдущими, но авторы полагают, что форма гидросиликатов в системе, не содержащей добавки, игольчатая. По мнению [53], морфология кристаллов в присутствии СаСІ2 из иглообразной превращается в решетчатую.
В отличие от этого в работе [7] обнаружено, что в продуктах гидратации C3S в присутствии СаС12 наблюдаются фибриллярные структуры. По данным [14], C3S, гидратировав - шийся при В/Т = 0,5, характеризуется игольчатой формой новообразований, тогда как введение 1—4 % СаС12 изменяет морфологию кристаллов: они становятся пластинчатыми или подобными гофрированной фольге. К близким выводам пришли и авторы работ [54, 55]. Подобное изменение в морфологии кристаллов может быть следствием хемосорбции хлорид-ионов на поверхности гидратных фаз и их внедрения в решетку C-S-H.
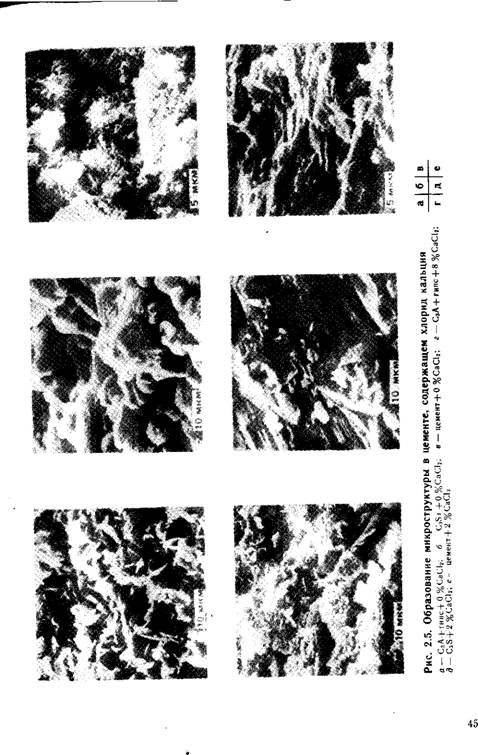
На рис. 2.5 ^представлено
Действие СаС12 на микроструктуру гидратирующихся C3S, C3A-|-CaS04-2Н20 и цемента. Введение 2 % СаС12 в цемент приводит к 50 %-ному повышению прочности и сильному уплотнению структуры цементного камня. Аналогично обстоит дело и с Сз5-|-СаС12, однако прочность при этом повысилась на 70%. При введении 8% СаС12 в систему СзА + гипс прочность увеличилась на 100 %, и структура из преимущественно состоящей из коротких игл преобразовалась в пластинчатую.
Различия в морфологии проявляются менее четко при низком В/Т, что объясняется плотной упаковкой и отсутствием свободных зон. По данным [33], гидратация C3S при В/Т = 0,3 с 2 и 5% СаС12 привела к 50—150 %-ному возрастанию микротвердости по сравнению с такой же пастой без добавки. По-видимому, это было обусловлено меньшей по - ристотью и более прочной ко- гезионной прочностью частиц. Согласно [57], хлорид кальция » повышает прочность паст из C3S вследствие перехода губчатых структур в ячеистые.
По данным [53, 58], при одинаковой степени гидратации C3S введение СаС12 приводит к морфологическим изменениям структуры новообразований,, что выражается и в различиях кривой распределения пор по размерам. Однако при этом нелегко определить поры размером менее 0,1 мкм. Авторы [31] пришли к выводу, что на прочность влияют, не столько
|
|
Внешние продукты гидратации C3S, фиксируемые с помощью сканирующей электронной микроскопии, сколько контактные взаимодействия между негид - ратированными зернами C3S (не наблюдаемыми под электронным микроскопом) и новообразованиями. Таким образом, можно констатировать, что морфология, плотность, пористость и химический состав новообразований — факторы, существенно влияющие на прочность гидратирующегося C3S.
Введение СаСІг влияет и на морфологию автоклавирован- ного C3S: в присутствии СаСІг не удается обнаружить обычно наблюдающихся фиброподоб - ных и прямоугольных кристаллов. Введение хлорида кальция не приводит также к кристаллизации Сз8Н!,5 и a-C2SH [43].
В работах [31, 34J изучено действие различных анионов: перхлоратов, тиоцианата, про - пионата, малеината и хлорида при одинаковом катионе Саг+. Обнаружены различия в морфологии C-S-H-фазы, в числе кристаллов СН на 1 мм2 и в их относительных размерах (табл. 2.1). Хотя эти данные не совсем ясны, можно заключить, что на прочность при растяжении определяющее влияние оказывает капиллярная пористость материала.'
По данным авторов [59], исследовавших морфологию продуктов гидратации C3S в присутствии 62 различных добавок, на нее больше влияет тип аниона, чем катиона. Многие добавки изменяют морфологию
Са(ОН)2 таким образом, что для него перестают быть характерными гексагональные фазы. Все добавки по их влиянию на отношение размеров осей кристаллов с/а можно разделить на 4 группы. Согласно
[57] , гексагональные кристаллы Са(ОН)г исчезают в присутствии СаСЬ и СгСІз, что не наблюдается при введении в качестве добавки Cdb.
2.2.1.4. Пдровая структура. Значительное число работ посвящено влиянию хлорида кальция на пористость и распределение пор по размерам в камне из C3S. По данным
[58] , при одинаковой степени гидратации C3S введение 1 % СаС12 снижает пористость образцов. Вместе с тем, судя по другим зависимостям, можно предположить, что хлорид кальция не влияет на удельный объем камня. Известно, что в присутствии СаС12 значительная часть порового пространства камня из C3S приходится на долю пор с радиусом менее 0,0065 мкм, не улавливаемых с помощью ртутной порометрии [21, 61, 62]. Так, согласно [63], через 1 сут гидратации C3S в присутствии 2 % СаСЬ большинство пор имело радиус 1—5 нм, а, по данным [64], при введении хлорида кальция гидравлический радиус пор камня из C3S составил 3,18 нм против 5,33 нм для эталона — камня без добавки.
Из данных рис. 2.6 (на котором изображена зависимость между общей пористостью и эффективным диаметром пор для C3S, гидратированного в раз
ные сроки при содержании. 1 % СаСЬ), следует, что со временем пористость уменьшается, причем главным образом за счет уменьшения доли более крупных пор [53]. Согласно [33J, между пористостью и выраженной в логарифмической зависимости микротвердостью камня из C3S, гидратирован- ного при В/Т 0,3—0,5 в присутствии 2—5 % СаСЬ, существует приблизительно линейная зависимость.
|
Таблица 2.1. ВЛИЯНИЕ ДОБАВОК НА МИКРОСТРУКТУРУ КАМНЯ ИЗ C. S
|
|
Примечание, с и а — оси кристаллов. |
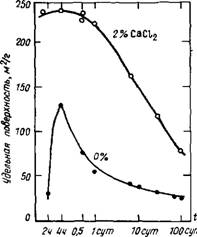
2.2.1.5. Удельная поверхность. Из данных по низкотемпературной адсорбции азота следует, что введение хлорида приводит к увеличению удельной поверхности камня из C3S [17, 37, 52, 54, 61, 63—65J. Однако степень влияния различна и зависит от В/Т, дозировки добавки и условий высушивания. При использовании в качестве адсорбата Н20 вместо N2 удельная поверхность камня возрастает, причем разница в удельной поверхности образцов с хлоридом кальция и без него невелика.
|
20 |
|
|
16 |
|
|
У |
|
|
CJ |
Гі |
|
8- |
8 |
|
И |
|
|
J |
І! |
|
І |
0 |
|
0,01 0,1 7 10 Эффективный диаметр пор, шм Рис. 2.6. Кривые изменения поровой структуры цементного камня иа основе C3S, гидратировавшегося с хлоридом кальция в течение разного времени (0,5; 1; 3; 7; 14; 30 сут) |
На рис. 2.7 представлена кинетика изменения удельной поверхности камня из C3S при его гидратации без добавок и с 2 % СаС12, по данным низкотемпературной адсорбции азота [54]. Согласно [14, 16], введение 5 % СаС12 повышает удельную поверхность камня по сравнению с 2 % СаСЬ; удельная поверхность камня при введении 2 % СаСЬ примерно в три раза больше, чем у эталона (без добавки). Рост
|
Рис. 2.7. Зависимость площади поверхности камня из C3S, содержащего хлорид кальция, от времени гидратации |
Удельной поверхности камня можно связать с уменьшением содержания Са(ОН)г при введении СаСІг [44]. Со временем удельная поверхность камня уменьшается в результате физических и (или) химических связей между частицами.
При степени гидратации C3S 64 % удельная поверхность камня, измеренная в парах воды, составила без добавки 324 м2/г, а при введении 2 % СаСІг — 261 ыг/т. Это было объяснено образованием в присутствии хлорида кальция более высокоосновных и более крупных гидросиликатов кальция [64]. Однако указанное положение нельзя считать бесспорным. Так, введение 5 % СаС12 привело к увеличению удельной поверхности камня на 15 м2/г по сравнению с введением 2 % СаСЬ, хотя основность гидросиликатов кальция в первом случае была более высокой.
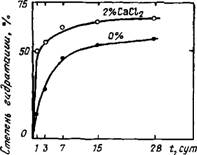
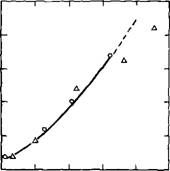
2.2.1.6. Рост прочности. Сокращение сроков схватывания и ускорение твердения в присутствии малых доз СаС12 обычно связывают с влиянием этой добавки на силикатные фазы цемента, прежде всего на C3S [14, 16, 19,20,24,31,33, 37, 40, 67] (рис. 2.8). Значительное повышение прочности образцов в возрасте 28 сут можно объяснить большей степенью гидратации C3S в присутствии СаСЬ, однако введение свыше 2 % хлорида кальция неэффективно [4,24] (рис. 2.9). При этом имеет значение также водотвердое отношение: при В/Т = 0,5 большую прочность обеспечивает добавка 2 % СаС12, а при В/Т = 0,3 — 0,2 введение добавки как 2, так и 5 % СаСЬ повышает прочность образцов из C3S примерно в одинаковой степени [33] (табл. 2.2).
|
Таблица 2.2. МИКРОТВЕРДОСТЬ ОБРАЗЦОВ ИЗ C3S, н/мм2, В ПРИСУТСТВИИ СаСІг
|
Повышение прочности образцов из C3S при введении 1—2 % СаСЬ нельзя объяснить только ростом степени его гидратации. Так, при сравнительно
невысокой степени гидратации C3S зависимость «степень гидратации — прочность при сжатии» без добавки и в присутствии 1 % СаС12 примерно одинакова, а при повышении степени гидратации прочность даже снижается (рис. 2.10) [58]. Очевидно, при оценке роли добавок следует принимать во внимание и ряд других факторов: пористость, морфологию и химический состав камня, его удельную поверхность, плотность и др.
При исследовании кинетики изменения структуры гидрати - рованного цементного камня с помощью триметилсилильного метода было установлено, что наблюдающийся в системе C3S—Н20 и p-C2S—Н2О переход ортосиликата (мономерная форма) в димер и полимер [68] ускоряется в присутствии хлорида кальция [69].
|
ПСж, мпа |
||
|
60 |
||
|
1 1 1 |
■ 1 |
|
|
50 |
- |
2% CaCt2 |
|
------------- 0- |
||
|
ЦО |
||
|
30 |
||
|
20 |
{^^ |
|
|
10 |
-JT |
- |
|
0 |
J—1_ 1 |
1 1 |
|
13 7 15 28 t, cym Рис. 2.8. Зависимость прочности при сжатии /?<■« камня из трехкальцчевого силиката, содержащего хлорид кальция, от времени гидратации |
В таких системах были обнаружены преимущественно Si207~-HOHbi с небольшим количеством тетрамерных колец, что, возможно, положительно влияет на прочность камня, хотя пока еще преждевременно утверждать, что полимеризация силикатных ионов—фактор, обеспечивающий рост прочности материала.
|
Псж, МПа |
|
30 ЦО 50 ВО 70 80 Степень гидратации, % Рис. 2.10. Зависимость прочности при сжатии Ясж, от степени гидратации алита, содержащего хлорид кальция |
|
Ясж^па |
|
СаС12,% Рис. 2.9. Зависимость прочности при сжатии камня из C3S в возрасте 28 сут от содержания СаСІг |
Существует хорошая корреляция между прочностью и пористостью. Линейная зависимость обнаружена между пористостью камня из C3S и его микротвердостью в присутствии 2 и 5 % хлорида каль-
OS і 30 10 50 60 70 80 Степень гидратации,%
Рнс. 2.11. Зависимость усадки камия нз алнта, содержащего 1 % СаС12-2Н20, от степени гидратации
1—0% СаСЬ; 2—1 % СаС12-2Н20
Ция. При исследовании в качестве добавок тиоцианата, пропионата, малеината, перхлората и хлорида кальция [31] с помощью ультразвуковой техники было обнаружено, что они повышают вязкость системы, по-видимому, благодаря увеличению степени гидратации C3S. Однако в присутствии хлорида кальция была зафиксирована аномалия: вязкость и пористость пасты при одинаковой степени гидратации C3S была ниже, чем для остальных добавок.
|
|
|
§ Ofi - ^ - |
|
1 ST 0,45 - £ |
|
СЛ |
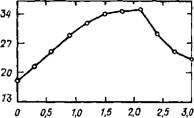
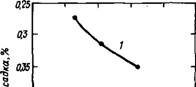
2.2.1.7. Усадка. В присутствии хлорида кальция усадка C3S возрастает, причем не только вследствие более полной гидратации алита. В работе [58] была сопоставлена усадка C3S - f - 1 %СаСЬ с эталоном при одинаковой степени гидратации. Оказалось, что независимо от того, как глубоко прошел процесс, усадка в присутствии хлорида кальция всегда была выше, однако зависимость между усадкой и степенью гидратации C3S была различной (рис. 2.11). і
2.2.2. ДвухкальциеВый силикат. P-C2S гидратиру^тся медленнее, чем C3S. Такі при одинаковой удельной поверхности
0. 45 м2/г и В/Т = 0/45 содержание C-S-H-фазы в возрасте
|
/ |
1, 3, 7 и 28 сут для J5-C2S составляло, соответственно, 4,9; 9,2; 15,2; 51,6 % против 34,4; 36,6; 45,5; 62 % для1 C3S [71]. Аналогично изменяется и прочность материала. Отношение C/S в продуктах гидратации P-C2S несколько выше, чем у C3S.
Сведений о влиянии хлорида кальция на гидратацию C2S сравнительно немного [52, 72— 76]. Об этом влиянии можно судить по данным табл. 2.3.
|
Таблица 2.3. СТЕПЕНЬ ГИДРАТАЦИИ P-C2S В ЗАВИСИМОСТИ ОТ ДОЗИРОВКИ ХЛОРИДА КАЛЬЦИЯ
|
Из которой следует, что СаСЬ ускоряет процессы гидратации C2S [38]. Ускорение наблюдается при любых В/Т [73]; к 250 сут степень гидратации возрастает на 20 %, однако в раннем возрасте этот эффект слабее, чем ускоряющее действие хлорида кальция на C3S. К 1—3 мес гидратации P-C2S в присутствии СаСЬ содержится лишь очень малое
количество Са(ОН)г по сравнению с эталоном (C2S без добавки) [24], что свидетельствует о повышении отношения C/S в присутствии хлорида кальция., Так, при введении 2 % СаСІг оно возросло с 1,7 до 1,82. Имеются сведения, что при этом некоторая часть хлорида кальция оказывается жестко связанной с гидратными фазами [26]. При нормальной концентрации СаС12 гидроксихло - риды кальция в этой системе не образуются.
Наблюдалось ускорение хлоридом кальция гидратации C2S и при температуре 80° С [25], тогда как комбинация из СаСІ2 + Са(ОН)г замедляет этот процесс [10].
При измерении удельной поверхности по методу низкотемпературной адсорбции азота (метод БЭТ) при введении хлорида кальция 0,168—0,18 л/кг пористость камня из P-C2S увеличилась [73], а по данным, полученным с помощью адсорбции паров воды, — уменьшилась. Так, через 35 сут гидратации (3-C2S в присутствии 2 % СаСЬ по данным, полученным последним методом, пористость камня из C2S снизилась на 9 %, а по методу БЭТ — увеличилась на 19% [52]. На изменение удельной поверхности камня из C2S хлорид кальция влияет незначительно. Так, при В/Т = 0,5 удельная поверхность камня увеличилась до 70 м2/г против 62 м2/г для проб без добавки [73].
Морфология продуктов гидратации C2S в присутствии
|
|
|
120 S | 100 •о Є 1 80 |
|
» З I do І 20 |
Рнс. 2.12. Зависимость кубнковой прочности камня иа основе C3S н Р—CjS от содержания СаСІг исходной тонкости помола F
СаС12 не изменяется (в отличие от действия этой добавки на C3S). Наблюдается лишь некоторое уменьшение размеров новообразований [73], в отдельных случаях — ускорение образования волокнистых гидросиликатов и их превращение в а-Сг8Н.
Прочность камня из P-C2S в присутствии хлорида кальция растет: при введении 3 % СаС12 к двум месяцам — на 26%, к трем — на 34 % и к шести — примерно на 60 % [78]. Аналогичные результаты получены и при использовании метода пластометрии [39].
Однако большие дозы СаСЬ отрицательно влияют на механические показатели образцов.
На прочность оказывает влияние также дисперсность P-C2S (рис. 2.12): с ее увеличением возрастает и ускоряющее действие хлорида кальция; такой же результат получен и для
C3s.
Данные по влиянию хлорида кальция и других солей на прочность камня из C2S при растяжении (степень гидратации C2S—60 %) неоднозначны, что указывает на различный характер новообразований [79].
2.2.3. Трехкальциевый алюминат (С3А). Известны два гидрохлоралюмината кальция: С3А-СаСІ2-хН20 и С3А-ЗСаСЬ-
• уЬЬО. Считается, что низко - хлоридная форма — основная при взаимодействии С3А с СаСЬ в обычных условиях.^ Ее удается синтезировать при комнатной температуре при смешении С3А с растворами гидроксида и хлорида кальция [80]. С3А-
• СаСІг-хНгО образует ряд твердых растворов с С4АН|3.
Высокохлоридная форма гидрохлоралюмината кальция образуется при более значительной концентрации СаСЬ— [81, 82]. СзА-СаСЬ-хНгО кристаллизуется в виде гексагональных пластинок; на рентгенограмме может быть идентифицирована по линии 0,81 нм.
Высокохлоридная форма гидрохлоралюмината кальция представлена игольчатыми кристаллами с характерной линией на рентгенограмме — 1,015 нм [83]. Эти две формы хлор - алюминатов удается различить и по эндотермическим эффектам на термограммах: при 190 и 350° С для СзА-СаСЬ-хНзО и 160° С для С3А-ЗСаСЬ-г/Н20 [81].
Изучение системы СзА — СаО — CaS04-2H20 — СаС12 — НгО в возрасте до 3 мес показало, что как состав новообразований, так и их количество, образующееся в разные сроки, зависят от исходного соотношения между взятыми компонентами [83, 84], причем могут выкристаллизовываться гексагональный й кубический гидроалюминаты кальция, гексагональные пластинки Са(ОН)г и игольчатые кристаллы эттрин - гита, пластинчатые кристаллы низкосульфатной формы гидро - сульфоалюмината кальция и гипса, игольчатые кристаллы высокохлоридной формы гидро - хлоралюминатов кальция.
В насыщенном растворе СаСЬ к 1 сут образуется С3А° ЗСаСЬ" ЗОН2О, который к 3 мес переходит в низкохло - ридную форму. При введении 9 % СаСЬ выкристаллизовываются и СзА-СаСЬ-^НгО, и гексагональные гидроалюминаты кальция; со временем эти последние переходят в СзАН6 кубический.
В присутствии 1 % СаСЬ сначала образуются гексагональные гидроалюминаты кальция, а к 3 мес новообразования представлены преимущественно гексагональной и кубической формами гидроалюминатов.
Реакции в системе С3А — насыщенный раствор хлорида кальция в основном завершаются к 14 сут, что свидетельствует о слабой экранирующей способности игольчатых
кристаллов хлоралюминатов, не препятствующих гидратации С3А [84].
Характер и кинетика реакций в системе СзА — СаО — СаС12 — Н20 зависят от концентрации СаСІг. В его насыщенном растворе сначала образуются иголки и пластинки Са (ОН) 2, которые в более позднем возрасте преобразуются в пластинчатый монохлорид кальция — гидрат и игольчатые кристаллы гидроксихлорида кальция. Введение 1 — 9 % СаС12 в эту систему не изменяет характера начальных стадий гидратации по сравнению с таковой для системы без добавки. Конечным продуктом гидратации и в присутствии 9 % СаС12 является С3АНб кубический.
В аналогичной системе в присутствии гипса в насыщенном растворе СаС12 сначала образуются игольчатые кристаллы высокохлоридной формы гидрохлоралюмината кальция и гидроксихлорида кальция, а к З мес преимущественными фазами оказываются низкохло - ридная форма гидрохлоралюмината кальция, эттрингит и гидроксихлорид кальция. Отсутствие эттрингита в течение первых 14 сут можно объяснить снижением растворимости гипса в растворе хлорида кальция [84].
Введение 1 и 9 % СаСЬ ускоряет реакцию образования эттрингита в исследованной системе: он обнаруживается уже через 4 мин, а к 1 сут реакция его образования практически полностью завершает-
V
1
0,75 0,50 0,25 О
Рис. 2.13. Зависимость скорости расхода v иа новообразования различных компонентов в системе СзА—гипс— СаС12-Н20 от времени
Ся. К 3 мес в системе сосуществуют гидраты монохлор - и моносульфоалюминатов кальция.
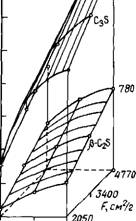
Данные по кинетике взаимодействия С3А с гипсом и СаСЬ в отсутствие СаО представлены на рис. 2.13. Сопоставление калориметрических кривых для системы СзА + 20 %CaS04-2H20 + + 12,5 % СаСІг с аналогичными кривыми для двойных систем: C3A + CaS04-2H20 и С3А + + СаС12 позволяет заключить, что хлорид кальция ускоряет реакцию образования эттрингита; низкохлоридная форма гидрохлоралюмината кальция образуется после завершения реакции между СзА и гипсом [23, 41, 85—88].
С3АН6 кубический тоже реагирует с СаС12 с образованием С3А-СаС12-л:Н20, однако эта реакция протекает менее интенсивно, чем в контрольной смеси [89].
|
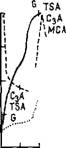
С3А TSA ' С4АН13 МСА Л |
|
..,■■^ "бСа504-2НгО / -'TSA=C3A3CaS04-32H20 V ІІЙІ Л « А. Л4 4AI|/Q |
|
' / М№С3АСаС1г-10Н>0 ' / 4ySA=C3ACaS04-12H20 |
|
CaCt? |
|
MSA MCA С4АН, З С3А |
|
TSA----- МСА І C3iA.1__ і__ і 2 3 4 5 в 7 8 9 t,4 |
При 75—100° С гидратация
СзА в присутствии хлорида кальция также приводит к образованию С3А-СаС12-хН20, однако с ростом температуры скорость этой реакции снижается [90]. Большая прочность, обнаруженная при добавлении СаСЬ (16%) к С3А, может быть объяснена кристаллизацией С3А-ЗСаС12-г/Н20 [87].
При использовании различных количеств гипса и хлорида кальция авторы [86] пришли к выводу, что ускорение с помощью СаС12 реакции С3А с гипсом сопровождается растягивающими напряжениями и снижением прочности образцов. В системе C3S — СзА — СаС12 — Н20 образуется больше С4АН13, причем хлорид кальция способствует повышению прочности материала. Этот результат, возможно, связан с тем, что в присутствии СаСЬ, ускоряющего гидратацию C3S, образуется больше Са(ОН)2 [24].
2.2.4. Ферритная фаза. Работ, посвященных исследованию действия СаС12 на гидра - цию ферритных фаз, сравнительно немного [26, 78, 85, 91, 92], по-видимому, потому, что процессы, протекающие в этой системе, близки к таковым для С3А [85, 91]. Хлорид кальция ускоряет реакцию между C4AF и гипсом, причем первоначально образуется трехсульфатная форма гидро- сульфоалюмоферрита кальция (ГСАФК-3); затем, после связывания всех сульфат-ионов кристаллизуется монохлорид - ная форма гидрохлоралюмо - феррита кальция (ГХАФК-1). 54
Присутствие СаСЬ тормозит превращение ГСАФК-3 в низкосульфатную форму ГСАФК-1 Введение 20% хлорид-ионов приводит к тому, что через 30 мин одновременно образуются треххлоридная форма гидро - хлоралюмоферрита кальция ГХАФК-3 и эттрингит.
На полноту реакции между ферритной фазой и сульфат - ионами в присутствии хлоридов влияет состав ферритных фаз: она возрастает в последовательности C2F<C4AF< ССбАгР. Степень взаимодействия и соответственно состав гидратных фаз, образующихся в системах C4AF — Н20 и C4AF — CaS04-2H20 — Н20 при очень низких В/Т отношениях, отличаются от таковых для нормальных В/Т, причем роль хлорида кальция при этом тоже различна [93, 94].