Добавки в бетон Справочное пособие
ВЛИЯНИЕ ВОДОПОНИЗИТЕЛЕЙ — ЗАМЕДЛИТЕЛЕЙ СХВАТЫВАНИЯ НА ПРОЦЕССЫ ГИДРАТАЦИИ ЦЕМЕНТА И ЕГО СОСТАВЛЯЮЩИХ
Большинство работ по этому вопросу посвящено исследованию влияния чистых лигно - сульфонатов, а также добавок на их основе.
4* кнцих цемента. Большая часть исследований содержит данные о влиянии лигносульфонатов на процессы гидратации С3А и C3S. Добавки-водопонизители другого состава, чем лигносуль- фонаты, будут рассмотрены отдельно (см. разд. 3.3.1.3 и 3.3.1.4).
3.3.1.1. Влияние лигносульфонатов на процессы гидратации СзЛ. Хотя содержание СзА в портландцементе мало, указанный минерал существенно влияет на сроки схватывания и ранние стадии гидратации цемента. Поэтому большинство работ посвящено выявлению роли добавок водопонизителей на гидратацию СзА.
Известны две метастабиль - ные формы гидроалюминатов— продуктов гидратации трех - кальциевого алюмината: гексагональные фазы С4АН13 и C2AHg, превращающиеся затем в стабильный кубический гексагидрат С3АНб по уравнениям:
2СзА + 21 H->-C4AH 13 С2 AHe (3.1)
И
С4АНіз+С2АН8->-2СзАНб + 9Н. (3.2)
Степень превращения гексагональных гидратов в кубический С3АНб зависит от температуры, водоцементного отношения и вида С3А. Введение лигносульфонатов замедляет оба процесса: и гидратацию СзА, и превращение гексагональных гидроалюминатов в кубический гексагидрат [7,23— 35], причем с ростом содержания лигносульфонатов усиливается их тормозящее процесс действие.
99
|
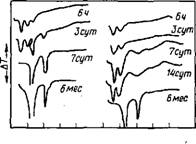
О 250450650800 0 250 450 650 800 Т°0 Рис. 3.7. Влияние лигносульфоната кальция (ЛСК) на гидратацию С3А (слева—гидратация СзА; справа—гидратация СзА с ЛСК) [27] |
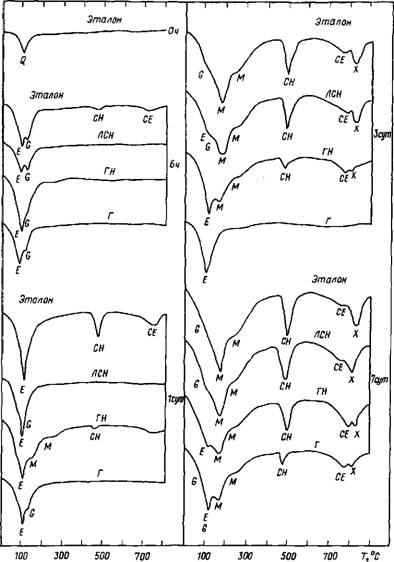
Данные табл. 3.6 иллюстрируют замедляющий эффект небольших дозировок лигносульфоната (0—5 %) на гидратацию СзА, а на термограммах (рис. 3.7) представлены данные дифференциального термического анализа (ДТА), полученные для продуктов гидратации СзА. Как видно, гексагональные гидроалюминаты можно идентифицировать по двум эндотермическим эффектам: первому при 150—200 °С и второму при 200—280 °С, тогда как два эндоэффекта кубического СзАН6 находятся в интервале соответственно 300—350 и 500— 550 °С.
В отсутствие лигносульфонатов СзАНб обнаруживается через 6 ч и становится основной фазой через 7 сут. В пробах, содержащих лигносульфонат, эту фазу отчетливо обнаруживают только через 14 сут, и она становится преобладающей лишь к 6 мес. Следовательно, можно заключить, что лигносульфонаты стабилизируют гексагональные гидроалюминаты кальция. Некоторые авторы [7, 24] объясняют этим отсутствие СзАН6 в раннем возрасте. При этом снижается также активность СзА (см. табл. 3.6).
|
Таблица 3.6. ВЛИЯНИЕ ЛИГНОСУЛЬФОНАТА КАЛЬЦИЯ (ЛСК) И СВОБОДНОГО ОТ САХАРОВ ЛИГ НА ПРОЦЕССЫ ГИДРАТАЦИИ СзА
|
|
Примечание. Цифры — относительное содержание СзА н гидроалюминатов |
Хотя общепризнано, что лигносульфонаты — эффективные замедлители гидратации СзА, имеются разные мнения в отношении роли Сахаров и соответствующих кислот в технических лигносульфонатах. Так, было найдено [28]; что свободные от Сахаров лигносульфонаты натрия или кальция обладают таким же замедляющим гидратацию С3А действием, как
И технические лигносульфона - ты. Это означает, что чистые лигносульфонаты должны быть при прочих равных условиях столь же эффективны в качестве замедлителей, как и технические, содержащиеся в промышленных добавках.
Согласно [7], чистый лиг - носульфонат натрия — худший замедлитель гидратации СзА, чем технический ли'носульфо - нат кальция (см. табл. 3.6). На этом основании делается заключение, что наиболее активные компоненты технических лигносульфонатов — редуцирующие вещества (сахара). Автор работы [10], разделив на основные составляющие два технических лигносульфоната, пришел к выводу, что наиболее сильно тормозят процессы гидратации СзА сахарные кислоты, а авторы исследований [10] и [27] обнаружили в техническом лигносульфонате ксилоно - вую и гексоновую кислоты.
Разногласия по данному вопросу кроются в разных методах разделения лигносульфонатов, а также в различии
|
СзА+ 5 % ЛСК |
|
14 |
|
90 |
НОСУЛЬФОНАТА НАТРИЯ (J1CH)
СзА -f 0,4 % ЛСН
90
10
|
Следы 2 6 |
|
0,5 0,5 0 |
Следы Следы 0
Кальция.
Их состава и молекулярной массы.
При введении больших дозировок лигносульфонатов (10—100% массы СзА) наблюдается образование их комплексов с алюминатами. Так, по данным [26], при добавлении 10—30 % лигносульфонатов кальция образуется их комплексное соединение с гидроалюминатом кальция, фиксируемое по появлению эффектов на термограммах, не присущих ни лигносульфонатам, ни гидроалюминатам кальция. С помощью сканирующей электронной микроскопии удается обнаружить ячеистые (ноздреватые), свернутые в спирали узкие пластинки. При повышении концентрации лигносульфоната до 50—100 % выпадает гелеобразный материал. Электронно-микроскопические исследования показывают, что это рыхлые некристаллические образования, а результаты изучения их удельной поверхности, ДТА, химического и рентгеновского анализов свидетельствуют о том, что эти продукты представляют собой основной лигносульфонат кальция со встроенным катионом А13+.
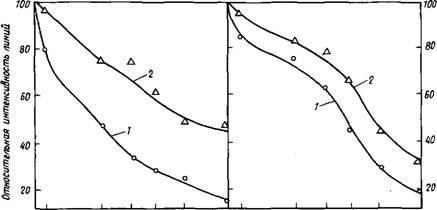
Замедляющее действие свободных от Сахаров лигносульфонатов натрия на процессы гидратации СзА и на твердый раствор СзА—Na20 в присутствии гидроксида кальция видно из рис. 3.8.
Рентгеновская дифракто - метрия позволяет проследить за кинетикой гидратации СзА по изменению относительной интенсивности линий, присущих безводной фазе. Как видно, лигносульфонаты более существенно влияют на процессы гидратации чистого СзА, чем на твердый раствор С3А—ЫагО [33, 34]. Эти данные означают, что замедляющий эффект лигносульфонатов зависит от содержания щелочей в портландцементе.
Очевидно, что введение добавок лигносульфонатов в качестве водопонизителей менее эффективно при использовании высокоалюминатных цементов и цементов с повышенным содержанием щелочей [1].
Авторы работы [38] предполагают, что присутствие большого количества щелочей в цементе может привести к взаимодействию между ними и лиг - носульфонатом и к ухудшению 102 его пластифицирующей способности.
|
О) 6)
0,08 0.5 г 6 1 7 0,08 0,5 ? S 1 7 Ч сут ч сут Время Время Рис. 3.8. Влияние не содержащего сахаров лигносульфоната натрия (ЛСН) на степень гидратации С3А(а) и твердого раствора C3A Na20 (б), определенную методом рентгенофазового анализа |134] I — контрольный образец; 2 — 1,25 % ЛСН |
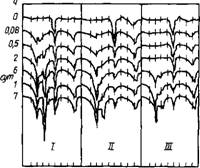
Одновременное введение лигносульфоната и карбоната натрия (соды) приводит к совместному торможению ими гидратации С3А, причем индукционный период процесса растет пропорционально концентрации добавок [32, 33]. Комбинация соды с лигносульфонатом натрия (по 1,25 % каждого) более сильно замедляет процесс гидратации СзА, чем лигносульфонат в той же дозировке в присутствии гидроксида кальция (рис. 3.9). Замедляющий гидратацию эффект можно оценить по потере массы проб в интервале температур 100— 300 °С, определенной на основе дифференциального термогравиметрического анализа (ДТГ).
Аналогичные данные получены с помощью калориметрического метода при исследовании чистого СзА [39]. Обнаружено, что на теплоту гидратации С3А влияет не только чистый лигносульфонат, добавленный в количестве 1 %, но в большей степени — лигносульфонат с добавкой 2 % соды. В этих исследованиях не обнаружилось торможения начальной стадии гидратации С3А в противоположность тому, что получили авторы [32, 33], используя другие методы, в том числе рентгеновскую дифрак - тометрию, ДТА и ДТГ.
Отсутствие индукционного периода зафиксировано при гидратации твердого раствора С3А—Na20 при введении как лигносульфоната, так и его смеси с содой (рис. 3.10). Пластифицирующее действие этих содо-лигносульфонатных добавок проявляется намного более четко при их введении в С3А, чем в твердый раствор СзА—Na20 [33, 34]. По-видимому, наличие щелочей в цементном клинкере играет иную роль, чем щелочи, вводимые с добавками.
Поскольку водопонижающее и замедляющее действие присуще только небольшим дозам лигносульфонатов, сделано заключение, что главную роль в механизме влияния этих добавок играет их адсорбция на клинкерных минералах и продуктах их гидратации [4, 40]. Выполнено значительное число работ по изучению адсорбции лигносульфонатов на С3А, а также на гексагональных и ку-
|
Ж |
100300 500 70S 100300500 700 1003005X700 Т,°С
Рис. 3.10. Влияние ЛСН или ЛСН + +карбонат натрия на степень гидратации твердого раствора СзА • NaaO (N0.25C2.75A) в присутствии Са(ОН)2, определенную методом ДГТ (/—III— то же, что на рис. 3.9) [331
|
100300500 700 100300500 700 100300500 700 Т.'С Рис. 3.9. Влияние ЛСН или J1CH + -(-карбонат натрия на степень гидратации СзА в присутствии Са(ОН)2, определенную методом дифференциальной термогравиметрии (ДТГ) [33] |
|
//—контрольный образец; //—1,25 % ЛСН; ///—1,25 % ЛСН + 1,25 % карбоната нагрия |
Бическом гидроалюминатах кальция [6, 21, 26, 40]. Поскольку в водных средах нельзя исключить гидратацию С3А, не удается и снять истинную
|
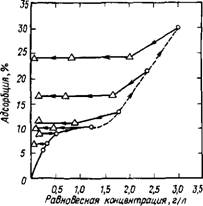
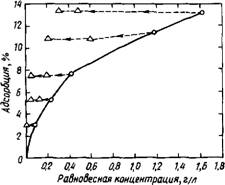
Рис. 3.11. Изотермы адсорбции — десорбции лигносульфоната кальция на гексагональном гидроалюминате кальция в водном растворе [26] |
Изотерму адсорбции лигносульфонатов в системах СзА — лиг- носульфонат — вода. Адсорбцию лигносульфонатов на СзА изучали в безводных средах, используя в качестве жидкой фазы диметилсульфоксид, а адсорбцию лигносульфоната —на гексагональных и кубическом гидроалюминатах кальция как в среде этого растворителя, так и в водных средах [26].
Анализ изотерм адсорбции лигносульфонатов на С4АН13 и С2АН8, диспергированных в воде, показал [26] (рис. 3.11) быстрое возрастание величины начальной адсорбции с ростом равновесной концентрации лигносульфонатов до 0,5 мг/мл, затем, при изменении их концентрации с 0,5 до 1,5 мг/мл, на кривых наблюдается плато (т. е. величина адсорбции не изменяется), а затем происходит повторное возрастание адсорбции в интервале концентрации лигносульфонатов от 1,5 до 3 мг/мл. Изотермы десорбции не совпадают с адсорбционными, причем необратимость составляет до 10 % количества адсорбированного лигносульфоната, свидетельствуя об образовании промежуточного комплекса.
При большей концентрации лигносульфоната изотермы десорбции лишь частично обратимы (см. рис. 3.11).
В работе [41] найдено, что максимум на изотерме адсорбции лигносульфоната натрия на чистом С4АН13, диспергированном в водном растворе гидро - ксида кальция, соответствует 5 % при равновесной концентрации лигносульфоната около 3 мг/м'л.
Измерения удельной поверхности [26], рентгеновская ди - фрактометрия [6, 7] и ДТА [6, 26, 27] свидетельствуют об образовании промежуточного комплекса лигносульфоната с С4АН13; это может ограничивать свободное перемещение ионов при переходе гексагонального гидроалюмината кальция в кубический [31].
В работе [26] исследованы изотермы адсорбции — десорбции водного раствора лигносульфоната кальция на СзАН6. После быстрой начальной адсорбции концентрация сорбтива приблизительно постоянна и составляет около 2 %. Фиксируется необратимая адсорбция лигносульфоната.
Рост удельной поверхности и необратимость адсорбции свидетельствуют о хемосорбции лигносульфоната кальция на
СзАНб, приводящей к его диспергированию.
В работе [26] были также исследованы изотермы адсорбции на СзАН6 лигносульфоната из водного раствора гидрокси - да кальция.
Изучение изотерм адсорбции.—десорбции лигносульфоната кальция из безводного раствора диметилсульфоксида на гексагональных гидроалюминатах показало быстрое увеличение адсорбции с крутым подъемом при 2,2 %.
Сканирующие изотермы показывают необратимость адсорбции даже при малых концентрациях лигносульфоната, что свидетельствует об образовании его комплекса с гексагональной фазой [6]. Аналогичные изотермы адсорбции получены в работе [41] при исследовании адсорбции лигносульфоната натрия из раствора диметилсульфоксида + 8% НгО на С4АН13. Согласно [31], количество сорбированного лигносульфоната из водных сред намного больше, чем из раствора диметилсульфоксида, в связи с тем, что высокое значение дипольного момента молекул воды приводит к их ориентации относительно поверхности гексагональной фазы.
В безводной среде не обнаружено сколько-нибудь существенной адсорбции лигносульфоната ни на СзА [6], ни на СзАНб [6, 41], что может быть связано с низкой удельной поверхностью этих фаз и природой их поверхности [31]. Прямые эксперименты показали, что в безводных средах, таких, как диметилсульфоксид, адсорбция лигносульфоната на гексагональных фазах С4АН13 и СгАНв значительно больше, чем на кубическом СзАНб или на СзА.
С другой стороны, адсорбция лигносульфоната из водной среды на СзА намного больше, чем на гидроалюминатах кальция, и лежит в интервале 15—450 % [26, 42—46] в зависимости от концентрации лигносульфоната, времени его контакта с твердой фазой, температуры и т. д. Однако в этих исследованиях под - вопросом остается правомочность применения самого понятия «адсорбция лигносульфоната на безводных составляющих цемента». Поэтому авторы работы [26] высказали предположение, что тенденция относить замедляющее действие лигносульфонатов на процессы гидратации СзА за счет их адсорбции на этой фазе должна быть изменена.
Адсорбция лигносульфоната на гидратирующемся С3А несколько уменьшается в присутствии соды (ЫагСОз). Найдено [39], что концентрация лигносульфоната в жидкой фазе пасты из С3А (В/Т = 0,5) за 15 мин уменьшается с 20 000 до 900 частей на 1 млн, тогда как в присутствии ЫагСОз за то же время — с 20 000 до 7200 частей на 1 млн. Возросшая в последнем случае концентрация лигносульфоната в жидкой фазе, вызванная присутствием соды, сопровождается большей подвижностью пасты. Авторы заключают, что
|
Концентрация добавок, г/л Рис. 3.12. Зависимость дзета-потенциала гидратирующегося СзА от добавок / — карбоната натрия; 2 — ЛСН; 3 — карбоната натрия+ЛСН |
Образуется комплекс между лигносульфонатом и СОГ2, обладающим большей анионной активностью и поэтому более сильным диспергирующим действием, чем чистый лигносуль - фонат.
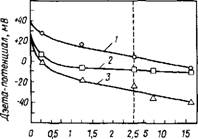
Эта гипотеза представляется достаточно правдоподобной, поскольку в работах [32, 33] отмечено, что в системе СзА— Н20 в присутствии смеси лиг - носульфоната с Na2C03 наблюдается более-сильное снижение ^-потенциала, чем при введении только одного лигносульфо - ната (рис. 3.12).
Изменение ^-потенциала признается важным фактором при объяснении диспергирования частиц цемента, обусловленного их электростатическим отталкиванием при адсорбции на них добавок-водопонизителей. Были проведены измерения ^-потенциала гидра - тируемого С3А [29, 32, 33] и чистых С4АН13 и СзАН6 [41 ] как в присутствии лигносульфонатов, так и без них. При этом установлено, что значение потенциала при перемешивании суспензии С3А в Са(ОН)2 (насыщенном) в течение 5 мин (состав суспензии: 1 ч. С3А на 100 мл раствора) составляет + 40 мВ, тогда как добавление к этой суспензии свободного от редуцирующих веществ лигносульфоната натрия снижает значение ^-потенциала до —20 мВ [32, 33] (см. рис. 3.12).
По данным [41], введение малых доз лигносульфоната натрия в водный раствор гид - роксида кальция приводит к резкому снижению ^-потенциала: С4АН13 — от —9,1 до — 18 мВ и СзАНе —от —8,7 до —12 мВ.
Основные аспекты механизма, замедляющего действия добавок, описаны также в разд. 3.3.1.3.
Лигносульфонаты изменяют и морфологию гидроалюминатов кальция, причем их влияние может быть разнообразным. Некоторые авторы [23, 47—49] наблюдали образование игольчатых кристаллов в присутствии лигносульфонатов, тогда как другие не находят их [7, 26] или вообще не обнаруживают никаких кристаллических новообразований в течение первых 4 мин гидратации [7]. В более поздние сроки найдены тонкие, свернутые в спираль продукты и очень тонкие пластинчатые гидраты. Обнаружено также, что при длительном хранении в присутствии лигносульфонатов образуется неидентифицирован - ный осадок из игольчатых кристаллов. Природа их неясна.
3.3.1.2. Влияние лигносульфонатов на процессы гидратации СзА в присутствии гипса. Согласно [50], при соотношении сульфата к алюминату, соответствующем характерному для портландцемента, и в присутствии гидроксида кальция гидратация СзА протекает по следующим стадиям.
Стадия 1. Часть СзА реагирует с гипсом с образованием эттрингита по уравнению
СзА + 3CaS04 • 2Н20 + 26Н20— ->-Сз А • 3CaS04 • 32Н20. (3.3)
Стадия 2. После израсходования гипса происходит превращение эттрингита в низкосульфатную форму гидросуль- фоалюмината кальция
2C3A + C3A-3CaS04-32H20 + 4H20^3(C3A-CaS04-12H20). (3.4)
Стадия 3. Оставшийся СзА частично взаимодействует с гидроксидом и моносульфо - алюминатом кальция по уравнению:
*СзА + *Са(ОН)2+(1-л:)СзА - •CaS04-12H20—СзА [Са(ОН)2],- • (1— x)CaS04-12H20, (3.5)
А оставшаяся часть СзА, реагируя с гидроксидом кальция и водой, образует С4АН19,
С3А + Са(ОН)2+ 18Н20—С4АН19.
(3.6)
Авторы работы [50], используя рентгеновскую дифракто - метрию, обнаружили, что добавление в систему СзА— CaS04-H20—Са(ОН)2—Н20 лигносульфоната кальция приводит к небольшому ускорению реакции между СзА и гипсом на стадии 1. Затем на стадиях
2 и 3 наблюдается заметное замедление реакции.
Аналогичные результаты получены в [23] при использовании метода ДТА. Эттрингит в присутствии лигносульфонатов удалось зафиксировать уже через несколько минут после начала реакции, тогда как его превращение в моносульфоалю - минат кальция отодвинулось с
3 ч в отсутствие лигносульфоната до 3 сут при введении этой добавки.
В работе [7] на основе данных рентгеновской дифрак - тометрии установлено (табл. 3.7), что лигносульфонаты несколько замедляют реакцию между СзА и гипсом. Замедление процессов гидратации СзА этими добавками в отсутствие гипса выражено сильнее (см. табл. 3.6).
Лигносульфонаты более существенно тормозят превращение высокосульфатной формы гидросульфоалюмината кальция — эттрингита в низкосульфатную форму: в отсутствие лигносульфоната эттрингит исчезает через одни сутки, тогда как при введении 0,2—0,4 % этой добавки он сохраняется в течение 14 сут, а в присутствии 5 % лигносульфоната — в течение 3 мес (см. табл. 3.7).
Данные [30], полученные с помощью термогравиметрического анализа, рентгеновской дифрактометрии, обычной и дифференциальной сканирующей калориметрии, подтверждают в целом результаты работы [7] в отношении влияния лигносульфоната на кине-
Таблица 3.7. КИНЕТИКА ГИДРАТАЦИИ В СИСТЕМЕ СзА—CaS04-2H20—Н20 ПРИ ВВЕДЕНИИ ЛИГн] И В ЕГО ОТСУТСТВИЕ |7]
|
СзА + ги 1 |
|
СзА + гипс |
|
Система |
СзА + гипс+0,2 % ЛСК
Продолжительность гидратаци!
|
90 |
|
14 |
|
1 |
90
СзА
Гипс
С2АН8
С4ан,
Эттрингит
|
7 2 0 0 1 Следы |
|
3 0 Следы 1 0 6 |
|
7 2 0 0 1 Следы |
|
2 Следы |
Моносульфоалюминат кальция
Примечание. Цифры означают относительную интенсивность пиков на дифракто
Тику реакции как между СзА и гипсом, так и превращения эттрингита в моносульфоалюминат кальция (рис. 3.13).
На этом рисунке показано изменение во времени дифференциальных кривых тепловьь деления для систем С3А — гипс — вода и СзА — гипс — лигносульфонат натрия (ЛСН) —вода. На кривых имеются два пика: первый (не виден на рисунке из-за быстрой реакции в системе С3А — гипс— вода) и второй, характеризующий превращение эттрингита в моносульфоалюминат кальция. Авторы делают вывод, что введение ЛСН тормозит как интенсивность, так и положение второго пика, не влияя существенно на первый пик [30].
Для исследования роли дефектов в кристаллах С3А, что способствует гидратации этого минерала, использован метод термолюминесцентного анализа [51]. Установлено существенное влияние этих дефектов на гидратацию С3А в присутствии гипса независимо от наличия добавок лигносульфоната или их отсутствия [30]. В цитированной работе [30] изучена адсорбция лигносульфоната натрия (ЛСН) на эт - трингите и моносульфоалюми - ната кальция в диметилсуль - фоксидном растворе с 8 % воды. При равновесной концентрации ЛСН, соответствующей 9 мг/мл, эттрингит и моносульфоалюминат кальция ад-
|
ОСУЛЬФОНАТА КАЛЬЦИЯ (ЛСК)
|
|
Граммах. |
Сорбируют соответственно 5,9 и 4,3 % ЛСН.
По-видимому, в одинаковых условиях и высокосульфатная, и низкосульфатная формы гид - росульфоалюмината кальция адсорбируют значительно больше лигносульфоната кальция, чем С4АН13 [40] (см. разд. 3.3.1.1).
По данным [30], адсорбция на C3A-CaS04-12Н20 сопровождается заметным изменением параметров его решетки, а в работе [7] сообщается, что базальные линии гидроалюминатов кальция и C3A-CaS04' •12Н20, полученных при гидратации С3А в присутствии гипса и добавки лигносульфоната, шире, чем без этой добавки.
Введение лигносульфоната изменяет морфологию как эттрингита, так и гексагональных гидроалюминатов кальция и C3A-CaS04-12H20, образующихся после израсходования гипса на реакцию с С3А [23, 25, 30, 52].
С помощью сканирующей
Электронной микроскопии установлено [23], что в водных пастах, состоящих из С3А+10% гипса + 5% гидроксида кальция, образуются очень длинные тонкие игольчатые кристаллы эттрингита; через 8 сут гидратации эти иглы превращаются в гексагональные пластинки. В присутствии технического лигносульфоната вместо длинных игл фиксируются очень маленькие игольчатые кристаллы [23].
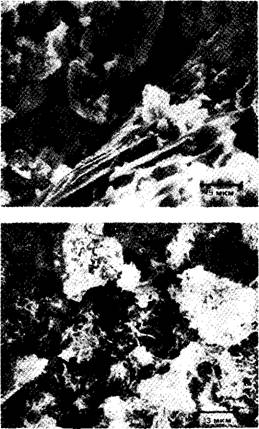
По данным [30], в пастах из СзА+ 20 % гипса в отсутствие лигносульфоната уже через 30 мин морфология эттрингита существенно отличается от той, которая присуща эттрингиту при введении лигносульфоната натрия (рис. 3.14, 3.15). Эти результаты согласуются с материалами исследования [52], которым установлено, что с введением в систему Сз A—CaS 04 • 2Н20—Са (ОН)2— Н20 лигносульфоната кальция (ЛСК) образующиеся игольчатые кристаллы эттрингита становятся тем тоньше, чем больше была концентрация ЛСК. Кристаллы эттрингита нмеют вид тонких войлоко - подобных частиц, образующихся из частиц СзА и гипса без какого-либо сращивания зерен, формирующих пасты. При этом пластифицирующее действие лигносульфоната может быть хотя бы частично обусловлено следующими двумя эффектами, каждый из которых, в свою очередь, связан с большей дисперсностью кристаллов эттрингита, экранирующих зерна СзА от действия
воды: 1) меньшей степенью образования эттрингита, что приводит к снижению водопо - требности паст; 2) уменьшением сращивания частиц эттрингита и снижением вероятности образования мостиков, соединяющих твердую фазу, благодаря чему улучшаются реологические свойства паст [30].
В литературе по цементным материалам термин «замедление» имеет двоякий смысл: его используют для обозначения и торможения процессов гидратации С3А и удлинения 110 сроков схватывания, причем из публикаций обычно не ясно, какой смысл вкладывают авторы в тот или иной контекст.
|
|
|
Рис. 3.14. Крупные иглы эттрингита в пасте СзА+20% гипса, гидратированной в воде в течение 30 мин [30] Рис. 3.15. Иглы эттрингита в пасте СзА + гипс, гидратированной в 1%-ном водном растворе лигносульфоната [30] |
Влияние лигносульфонатов на процессы гидратации твердого раствора С3А—Na20 можно определить, измеряя долю оставшейся в жидкой фазе щелочи при гидратации эквимоляр - ных смесей натриево-кальцие - вого алюмината и гидроксида кальция с количеством гипса, достаточным для достижения молярного отношения S03: :А12О3 = 0,5 [50]. В качестве
источника гидроксида кальция служит 1 моль Са(ОН)г или C3S на 1 моль натриево-каль - циевого алюмината.
В табл. 3.8 сведены результаты химических анализов жидкой фазы через 10 мин и через 17 ч после начала гидратации описанной системы (данные представлены в пересчете на Na20 и S03). Количество свободной щелочи в воде найдено эквивалентным количеству прогидратировавшегося алюмината кальция [12].
Очень раннему ускорению первой стадии реакции гидратации. Поскольку лигносульфонаты сильно затормаживают гидратацию C3S (см. разд. 3.3.1.6), выделяющийся при этом свободный гидроксид кальция также поступает в раствор весьма медленно, тогда как высокая щелочность раствора понижает растворимость всех соединений, содержащих Са(ОН)2.
3.3.1.3. Влияние других органических добавок на процес-
|
Таблица 3.8. ВЛИЯНИЕ ЛИГНОСУЛЬФОНАТА КАЛЬЦИЯ (ЛСК) НА ПРОЦЕССЫ ГИДРАТАЦИИ ТВЕРДОГО РАСТВОРА Na20—СзА В ПРИСУТСТВИИ ГИПСА И ГИДРОКСИДА КАЛЬЦИЯ |501
|
Сопоставление смесей А и Б свидетельствует о замедляющем действии Са(ОН)2; сопоставление смесей Б и В — о слабом замедляющем действии лигносульфоната кальция в ранние сроки и заметном замедляющем действии в более поздние сроки. Высокая концентрация сульфат-ионов (в пересчете на S03) указывает на то, что эттрингит не превратился в моносульфоалюминат кальция. Замена Са(ОН)2 на C3S в присутствии лигносульфоната кальция (смеси В и Д) приводит к более быстрому освобождению щелочи и поэтому сы гидратации СъА. Органические добавки, обладающие во - допонижающим действием, включают две группы веществ: гидроксикислоты [53, 54] и углеводы [54]. Они замедляют как гидратацию С3А, так и превращение гексагональных гидроалюминатов кальция в кубический гексагидрат. Предложено несколько гипотез для объяснения замедляющего действия органических добавок - водопонизителей, включая лигносульфонаты, на гидратацию С3А. Они обобщены [55, 56], и их действие может быть сведено к адсорбции, осаждению на твердой фазе и образованию комплексов.
Адсорбция. Замедляющее действие органических веществ на гидратацию С3А естественно связать с их адсорбцией на поверхности мета - стабильных первично образующихся гексагональных фаз
[57] . Данные о поверхностных комплексах органических веществ с гексагональными фазами получены с помощью ДТА
[58] ; обнаружен экзотермический эффект при 400°С в пастах из СзА и 1 % глюконата кальция, глюконовой кислоты или глюкозы. В исследовании
[59] показано, что молекулы органических веществ могут проникать между слоями С4АН13 и образовывать гомеополярные поверхностные комплексы благодаря вандерваальсовым силам и водородным связям.
Адсорбция салициловой кислоты из этанола на безводном С3А весьма мала, тогда как на продуктах его гидратации она значительна [14]. С другой стороны, адсорбция салициловой кислоты, а также лигносульфонатов на С3А в водной среде уменьшается в случае прегидратированного СзА [46]. Поэтому представление о том, что замедляющее действие органических веществ на гидратацию связано с их адсорбцией на безводной фазе [40], изменилось в пользу адсорбции добавок этого типа на продуктах гидратации цемента, таких, как гидратированный С3А [26].
Автор работы [60] предположил, что причина замедляю - 112 щего действия рассматриваемых добавок кроется в водородной связи их гидроксигрупп. Согласно [61], многие, вещества, обеспечивающие /замедляющий гидратацию Эффект, содержат карбонильные группы и гидроксильную группу в а-положении. Обнаружена также аналогичная зависимость для Сахаров, причем, если эти группы первоначально отсутствовали, то они непременно появлялись в щелочной среде [62]. Соответственно, трегало - за, не содержащая а-гидро - ксильных групп и не образующая их в водной фазе в контакте с цементом, не способна к замедлению процессов его гидратации. Однако в работе [64] установлено, что трёга - лоза — сильный замедлитель гидратации С3А. По данным исследователей [63], карбоксил- и а-гидроксилкарбониль - ные группы сами не тормозят сколько-нибудь существенно процессы гидратации С3А. Так, миндальная кислота — ускоритель гидратации С3А. На этом основании сделан вывод, что замедляющее гидратацию С3А действие присуще тем органическим веществам, которые содержат две и более гидроксиль - ные группы [63].
Сорбция органических водопонизителей может тормозить оба процесса: и образование гексагональных гидроалюминатов кальция, и их превращение в кубическую фазу. Поэтому очень стабильные, плотные оболочки из гексагональных гидроалюминатов кальция, формирующиеся вокруг зерен
СзА и блокирующие их, также могут быть причиной замедления процессов гидратации этого минерала. Согласно [55, 56], замедляющее действие органических водопонизителей коррелирует с общим количеством в их молекулах гидроксильных, карбоксильных и карбонильных групп. Следовательно, такие вещества, как глюкоза, глюко - новая и глюкуроновая кислоты, эффективно замедляют гидратацию СзА [58].
Осаждение. Идея осаждения на безводных фазах нерастворимых солей—продуктов взаимодействия кальций - ионов с органическими веществами как причина торможения ими гидратации СзА и других составляющих порт - ландцементного клинкера высказана в работе [64]. Эти вещества создают барьер на безводных фазах, препятствующий прониканию воды. Однако не всегда наблюдается требуемая согласно этой концепции корреляция между растворимостью кальциевых солей кислот и их тормозящим гидратацию действием. Так, растворимость оксалата кальция равна 5-Ю""6 моль/л, но он не обладает замедляющим гидратацию эффектом, тогда как растворимость соли глюконовой кислоты равна 8-Ю-3 моль/л, но она тормозит гидратацию С3А [58, 65].
Формирование комплексов. В работе [61] предположили, что органические вещества, содержащие одну или больше кислородсодержащих функциональных групп, таких, как НО—С — С = 0, в которых атомы кислорода расположены близко один от другого, способны образовывать в растворе хелатные комплексы с кальций-, алюминий-, железо-. и силикат-ионами. Поэтому комплексообразование может играть важную роль в механизме замедляющего действия этих веществ [55, 63, 66].
Согласно [63], для замедления процессов гидратации не обязательно присутствие а-гидроксилкарбонильной группы. Простые органические вещества, содержащие карбоксильную и гидроксильную группы или не имеющие ОН-группьг, не замедляют гидратацию С-зА, тогда как органические соединения с двумя и более гидро - ксильными группами тормозят гидратацию СзА. По-видимому, вследствие этого органические вещества с карбоксильной и не менее чем с двумя гидроксиль - ными группами (например, глицериновая и глюконовая кислоты) относятся к хорошим замедлителям гидратации.
Хотя кальций-ионы способны координировать гидрокси - кислоты и двухосновные кислоты, эти комплексы недостаточно стабильны. Не наблюдается также корреляции между константами устойчивости этих комплексов и их замедляющим гидратацию эффектом [55]. Кромеч того, в связи с низкой константой устойчивости комплексов и незначительной концентрацией органических добавок при высоком уровне концентрации кальций - ионов в водных растворах равновесная концентрация последних мало изменяется. Соответственно связывание кальций-ионов в комплексные соединения не может быть существенным фактором торможения ими процессов гидратации [55].
Эффект комплексообразова - ния может играть более существенную роль для ионов алюминия и железа в связи с их малой концентрацией в растворе. Анализы водных растворов при гидратации цемента показали, что в присутствии Сахаров концентрация этих ионов возрастает. Добавление (1 %) к СзА таких органических веществ, как сахароза, сахарная и винная кислоты, приводит к росту концентрации кальций - и алюминат-ионов в момент контакта С3А с водным раствором этих веществ [55]. Установлено образование комплексов при взаимодействии алюминия с салициловой кислотой [68].
В исследовании [69] найдено, что оптическое вращение таких редуцирующих веществ, как глюкоза и мальтоза, внезапно уменьшается после нескольких минут их контакта с С3А, что совпадает с выпадением углеводов из растворов. Реакцию с С3А можно предотвратить, используя нередуци - рующие моносахариды, полученные блокированием полу- ацеталей метильными группами [69].
Используя методы измерения оптического вращения, инфракрасной спектроскопии и ядерного магнитного резонанса, авторы [Б9] обнаружили, что при взаимодействии в растворе с такими соединениями, как глюконат и мальто^ионат, образуются комплексы, і содержащие углеводы: глю(козу и мальтозу. Через несколько минут эти комплексы осаждаются на оставшихся зернах РзА, что совпадает с уменьшением оптического вращения органических веществ.
По данным [70], алюминат - ионы образуют прочные комплексы с углеводами. Согласно [69], гидроксильйые группыпри этом включаются в образование комплекса. Однако карбо - ксилаты, которые замещают гидроксильные группы в исходных углеводах,— более сильные комплексообразователи. Хотя алюминат натрия также участвует в формировании подобного комплекса, авторы [69] приходят к выводу, что комплекс с С3А содержит в основном алюминаты, а не кальций. Однако трудно объяснить, как при этом анионы алюмината могут координироваться с отрицательно заряженными глю - конатами.
Образованием растворимых комплексов алюминат-ионов с органическими веществами можно объяснить начальное повышение активности при гидратации СзА в присутствии малых количеств Сахаров [50, 63]. Это может быть причиной того, что подобные дозировки Сахаров выполняют функции ускорителей и эпизодически приводят к ложному схватыванию портландцемента [56, 63]. Очевидно, растворение СзА предшествует его экранированию продуктами гидратации.
Таким образом, представляется, что общее замедляющее действие органических веществ включает также потенциальное ускорение начальной стадии гидратации, чему способствует комплексообразование с участием алюминатов и последующее замедление процессов гидратации благодаря стабилизации гексагональных фаз за счет адсорбции органических молекул на поверхности гидратов и образованию на их поверхности защитных пленок. Отмечено [57], что такие органические добавки-водопонизители, как глюкоза, молочная, глюконовая и малоновая кислоты, тормозят превращение гексагональных гидроалюминатов в СзАНб кубический за счет стабилизации гексагональных фаз. Через сутки при 60 °С и 75 %-ной влажности С3АН13 полностью превращается в СзАНб и Са(ОН)2, тогда как при относительной влажности 33 % наблюдается лишь частичное фазовое превращение. Если же С4АН13 контактирует с водным раствором глюкозы, то фазовый переход при 60 °С возможен лишь при 100 %-ной относительной влажности [57]. При введении в эту систему органической добавки наблюдается возрастание базальных расстояний, что характерно для поверхностных соединений. Эффект от введения глюкозы и других органических веществ в пасты из СзА тот же, что и в пасты из чистого с4ан13 [57].
В работе [71] найдено, что введение 1 % сахарозы замедляет гидратацию СзА путем торможения образования СзАН6 и выделения плохо закристаллизованного с4ан13. Формирование поверхностных соединений в присутствии глюконатов кальция и натрия установлено с помощью ДТА по эндотермическому пику на термограмме при 80 °С [58, 65]. Отмеченный пик невозможно отождествить с аналогичным пиком для с4ан19, поскольку при высушивании этот гидрат превращается в С^АН^.
На основании работ различных исследователей можно расположить большинство наиболее распространенных добавок- водопонизителей по их замедляющему действию в следующий ряд: кислоты типа глю - коновой> углеводы (такие, как глюкоза и сахароза) > лигносульфонаты [7, 35, 58]. На рис. 3.16 представлены результаты гидратации СзА при температуре 20 °С в присутствии 0,3 % лигносульфоната натрия (свободного от Сахаров), глюконата натрия и глюкозы, позволяющие сравнить их относительную эффективность [72].
3.3.1.4. Влияние других органических добавок на процессы гидратации СзА в присутствии гипса. Информация о влиянии добавок-водопонизителей (кроме лигносульфонатов) на систему СзА—CaS04-2H20— Н20 недостаточна, хотя и важна, особенно если принять во
|
Рис. 3.16. Кинетические кривые потерь при прокаливании СзА, гидратирован - ного в воде (/) и водных растворах, не содержащего сахаров ЛСН (2), глюконата натрия (3) и глюкозы (4) [72] |
Внимание возможность ложного схватывания цемента в подобных системах (см. разд. 3.3.1.12).
Морфологию эттрингита можно изменить с помощью Сахаров [56, 57]. Эттрингит образует столбчатые структуры с сульфат-ионами и большим числом молекул воды внутри этих структур [73]. Существует возможность того, что органические молекулы проникают внутрь столбчатых структур и стабилизируют эттрингит, это согласуется с данными о замедлении сахарами превращения эттрингита в моносульфоалюминат кальция С3А - - CaS04- I2H2O.
Эксперименты показали, что скорость реакции по уравнению (3.3) зависит также от того, в какое время добавлены сахара. Так, в отсутствие сахарозы время, требуемое для достаточно полного осуществления этой реакции, составляет для системы СзА—CaSO-r •2Н20—Н20 17 ч при молярном отношении S03/A1203 = = 0,5 и В/Т = 2. Добавление 0,7 % сахарозы в эту систему изменяет время с 17 до 1,5 или 60 ч — в зависимости от того, введена сахароза сразу или через некоторый период. Эти опыты показывают, что не всегда возможно отнести одну и ту же добавку к ускорителям, замедлителям или не влияющим на кинетику гидратации веществам при воздействии на цементы и их составляющие. Помимо состава и концентрации добавок [27, 63], имеет значение также способ их введения. При введении сахарозы с водой затворения в систему C3A + CaS04-2H20 уже через 7 мин на твердой фазе сорбируется 99 % сахарозы, препятствующей образованию типичных тонких и относительно плотных непроницаемых пленок эттрингита на зернах С3А [50]. Поэтому гидратация С3А в присутствии гипса может протекать более интенсивно до тех пор, пока не образуется эттрингит в количестве, достаточном для обычного Торможения процесса. Если в таком цементном тесте с низким В/Ц образуется сравнительно большое количество эттрингита, то этот последний может вызвать ложное схватывание. Если же реакции в системе С3А— —CaS04-2H20—Н20 в течение нескольких минут будут протекать в отсутствие сахарозы, то после ее введения адсорбция на твердой фазе уменьшится [50]. Соответственно в жидкой фазе сохранится больше этой добавки, и она будет тормозить все три описанные ранее стадии реакций, протекающих по уравнениям (3.3) — (3.6). Это позволяет объяснить, почему введение добавок в бетонные смеси с некоторой задержкой приводит к уменьшению их сорбции и к исключению слишком раннего схватывания цемента [74].
3.3.1.5. Влияние добавок водопонизителей-замедлителей на процессы гидратации С4Л/ Продукты гидратации C4AF, а равно и новообразования, выкристаллизовывающиеся в присутствии гипса, очень похожи на те, которые рассмотрены при изучении системы С3А— Н20— добавка и СзА—CaS04: • 2Н20—Н20— добавка: они изоморфны С2АНв, С4АНіз, С3АНб, С3А• 3CaS04• 32Н20 и C3A-CaS04- 12Н20 с частичным замещением в них алюминия на железо [75].
Степень гидратации C4AF, однако, заметно ниже, чем С3А. Эти реакции протекают согласно уравнениям (3.1) — (3.6) [49]. При гидратации C4AF сорбируется намного меньше добавки, чем при гидратации С3А [45, 50].
Точно так же при гидратации C4AF образуются комплексы с глюконатом натрия; однако они приводят к меньшему изменению величины оптического вращения и появляются позднее, чем аналогичные комплексы при реакции глюконата натрия с продуктами гидратации С3А [69].
В работе [76] исследовано влияние на гидратацию C4AF
|
Ч 1 сут Время Рис. 3-і7. Влияние не содержащего Сахаров лигносульфоната натрия (ЛСН) на гидратацию C2AF [ 76 J / — контрольный образец; 2— 0,625 % ЛСН; 2 — 2,25 % ЛСН |
Лигносульфоната натрия (ЛСН), свободного от Сахаров, и смеси этой добавки с карбонатом натрия [76]. При гидратации таких паст с 0,625% ЛСН в течение 9 ч не обнаружено никакой сколько-нибудь существенной разницы в продуктах гидратации по сравнению с контрольной пастой (без добавки). Позднее, через 1—7 сут, ЛСН влияет на превращение гексагональных фаз С2(А, F)H8 и С4(А, F)H13 в кубический С3(А, F)He. При введении 2,5 % ЛСН образование Сз(А, F)H6 замедляется до 7 сут, причем возникающие гидраты аморфны и могут быть идентифицированы лишь с помощью ДТА и ДТГ, но не рентгеновского дифрактометриче - ского анализа [35].
На рис. 3.17 показано влияние свободного от Сахаров лигносульфоната натрия (ЛСН) на кинетику гидратации C4AF. При добавлении 0,625 % JICH он выступает в качестве слабого
ускорителя процесса, тогда как повышение дозировки ЛСН до 2,5 % приводит к торможению гидратации C4AF [76]. С другой стороны, в работе [35] определено, что даже малые дозы лигносульфонатов (0,125 %) замедляют процессы гидратации C4AF. Однако авторы [35] использовали технический лигносульфонат кальция, содержащий сахара, и изучали гидрацию C4AF при высоком водотвердом отношении — В/Т—20.
Эти исследования показали также, что салициловая кислота — несколько более эффективный замедлитель гидратации C4AF, чем лигносульфо - наты. Обе добавки приводят к некоторому увеличению удельной поверхности гидратов и затормаживают превращение аморфизованных гексагональных гидратов в кубические.
|
60 - § W - I T I 20- C; 0 L |
|
OS 1 3 6 9 2Ц 3 7 " Время ' сУт Рис. 3.18. Влияние смеси карбоната натрия и не содержащего Сахаров ЛСН на гидратацию C4AF [76] / — контрольный образец; 2 — 0,625% карбоната натрия+0,625% ЛСН; 3—2,5% карбоната на - трия + 2,5% ЛСН |
Добавление смеси лигносульфоната и карбоната натрия вызывает тем более сильное замедление гидратации C4AF, чем выше дозировка добавки, причем, как следует из данных, приведенных на рис. 3.18, удлиняется индукционный период гидратации QAF [76]. При этом наблюдается снижение ^-потенциала до —45 мВ.
Сильное торможение процесса гидратации и диспергирующий эффект, обусловленный заметным отталкиванием частиц при отрицательном значении ^-потенциала, могут объяснить разжижающее воздействие этих добавок на систему.
3.3.1.6. Влияние водопонизителей-замедлителей на процессы гидратации C3S. Трехкальциевый силикат гидратируется с образованием геля C-S-H и Са(ОН)2 по уравнению
C3s + h2o—C-S-H + CH. (3.7)
Подробнее эта реакция обсуждается в гл. 1.
На кривых ДТА и ДТГ для паст из C3S наблюдаются два эндотермических эффекта при ~150 и 500 °С, принадлежащих, соответственно, C-S-H и СН. Еще один эффект при 800 °С, принадлежащий СаС03, может быть зафиксирован в том случае, если в процессе гидратации пасты из C3S не была исключена ее карбонизация.
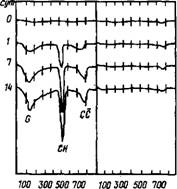
Из кривых ДТГ (рис. 3.19) следует, что в присутствии 0,3 % свободного от Сахаров лигносульфоната натрия гидратация C3S тормозится вплоть до 14 сут [77]. По данным [28], полученным с примене-
ниєм калориметрии, введение 0,3 % технического лигносульфоната кальция, а также свободных от Сахаров лигносульфонатов натрия или кальция замедляет так называемый индукционный период гидратации C3S с 7 до 20—40 ч, а также уменьшает степень гидратации в период ускорения [78] . Однако в дальнейшем не было обнаружено торможения самого процесса гидратации C3S. Это противоречие может быть объяснено различиями в использованных материалах, условиях гидратации C3S и методах исследований.
Согласно [79—81], в присутствии 0,5—0,8 % технических лигносульфонатов, свободных от Сахаров, гидратация C3S затормаживается на неопределенно долгий срок. По данным [50 и 79], введение малых количеств различных типов лигносульфоната кальция (— 0,5 %) в пасты из C3S очень сильно удлиняет сроки их схватывания, хотя некоторые из добавок содержали ощутимые количества СаС12 и только незначительные — Сахаров и соответствующих кислот. С помощью рентгеновской дифрактометрии не удалось обнаружить образования гидроксида кальция. В присутствии щелочей отмечается в конечном счете меньшее удлинение сроков схватывания C3S, и эффект изучаемых добавок приближается к тому, который наблюдается для портландцемента. По-видимому, щелочи реагируют с лигносульфо-
|
Т.°с Рис. 3.19. Кривые ДТГ для безводного и гидратироваииого С3А без добавок (слева) я с добавкой 0,3 % не содержащего Сахаров ЛСН (справа) [77] G — гель CSH; СС — СаСОз; CH — Са(ОН)2 |
Натами, нарушая их тормозящее действие на процессы гидратации C3S [50].
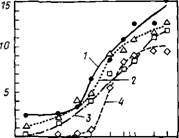
Меньшие дозы лигносульфонатов (порядка 0,1 %) слабо замедляют или ускоряют гидратацию паст из C3S — в зависимости от химического состава и молекулярной массы лигносульфонатов (рис. 3.20). При этом фракции лигносульфонатов, бедные низкомолекулярными органическими веществами (такими, например, как сахара и сахарные кислоты), действуют как слабые ускорители, тогда как фракции лигносульфонатов, богатые низкомолекулярными веществами, замедляют процесс, причем более сильно влияют на начальную стадию гидратации (индукционный период), чем на степень его гидратации в целом [79].
Автор работы [79] прихо
дит к выводу, что фракции лигносульфонатов, не содержащие Сахаров,— более сильные замедлители, чем аналогичные фракции лигносульфонатов, содержащие сахара. Сахарные кислоты, по-видимому, обладают более сильным тормозящим гидратацию C3S действием, чем сахара.
Введение 0,1 % глюкозы приводит к замедлению начальной стадии гидратации C3S, сменяющемуся слабым ускорением процесса, аналогично тому, что было найдено для лигносульфонатов, богатых сахарными кислотами [79]. Однако глюкоза, как видно из рис. 3.20, обеспечивает более длинный индукционный период гидратации C3S.
Определено, что салициловая кислота в дозировке 0,125% не замедляет сколько-нибудь существенно гидратацию C3S, тогда как та же доза лигносульфоната кальция тормозит степень гидратации в течение первых 7 сут [35].
|
40 45 г, сут |
Введение 0,1 % глюконата натрия замедляет гидратацию C3S на протяжении 50 сут (см. рис. 3.20), в то время как меньшие дозировки этой добавки (порядка 0,01 %) повышают степень гидратации C3S после индукционного периода продолжительностью 1 — 2 сут [79].
Добавки по их замедляющему гидратацию C3S эффекту можно расположить в тот же нисходящий ряд, который был указан в разд. 3.3.1.3 в отношении С3А, а именно: глюко - новая кислота и подобные ей кислоты> углеводы (такие, как глюкоза)> лигносульфонаты.
Исследование процессов гидратации C3S в присутствии 0,1 % глюкозы либо лигносульфоната, содержащего значительное количество сахарных кислот или 0,01 % глюконата, показало, что в сроки до 7 сут в этой системе с помощью рентгеновской дифрактометрии не удается обнаружить никаких продуктов гидратации (см. рис. 3.20), а по данным сканирующей электронной микроскопии поверхность C3S покрыта частичками C-S-H пластинчатой, но не игольчатой формы [79]. В этот период с помощью ДТА удаотся зафиксировать лишь аморфный СН, однако в более поздние сроки и ДТА, и рентгеновская ди- фрактометрия позволяют обнаружить кристаллический СН [79].
|
Рис. 3.20. Влияние 0,1 %-иого раствора глюкозы, глюкоиата иатрия и лигносульфоната с высоким и низким содержанием сахарных кислот иа гидратацию C3S / — бещ добавок; 2 — глюкоза; 3 — глюконат; 4,5 — с ЛСН соответственно с высоким и низким содержанием сахарных кислот |
В разбавленных суспензиях C3S без добавок (В/Т = 20) наблюдается рекристаллизация
СН, при этом фиксируются гексагональные пластинки и кристаллические новообразования [35]. При больших дозах лигносульфоната (около 0,5 %) с помощью электронной микроскопии установлено присутствие тонких волокон C-S-H вокруг зерен C3S вплоть до З мес гидратации, тогда как игольчатые частицы СН встречались редко и в виде отдельных иголок [82].
Подъем на термокинетической кривой после индукционного периода гидратации C3S может быть несколько понижен при добавлении 2 %Na2C03 и 1 % лигносульфоната. При этом с помощью кондуктомет - рического калориметрического, метода удается установить некоторое замедление степени гидратации C3S, однако без полного торможения начальной стадии процесса [77].
По данным ДТА и ДТГ, процесс гидратации C3S с добавлением 0,3 % Na2C03 + + лигносульфонат натрия полностью тормозится в течение лишь 7 сут (рис. 3.21), тогда как в присутствии только одного лигносульфоната натрия (0,3 %) — в течение не менее 14 сут. Введение лигносульфоната натрия обеспечивает более сильный замедляющий эффект, чем добавление его смеси с содой. Анализ жидкой фазы свидетельствует об уменьшении концентрации Са2+- ионов в присутствии комбинированной добавки (сода+лиг - носульфонат) по сравнению с введением одного лигносульфоната натрия.
|
Ч сут Рис. 3.21. Кинетические кривые количества гидроксида кальция, образующегося в камие из C3S, гидратирую - щемся без добавок и с добавками карбоната натрия и лигносульфоната натрия (ЛСН) [77] 1 — без добавок; 2 — 0.3% карбоната натрия; 3 — 0,3% ЛСН; 4 — 0.3% карбоната иатрия+ +0.3% ЛСН |
В контрольной пробе (без добавок) концентрация Са2+ и ОН-ионов была ниже, чем в присутствии лигносульфоната натрия [39]. С другой стороны, концентрация лигносульфоната в жидкой фазе системы C3S—НгО — лигносульфонат была намного выше, чем в системе СзА—Н20, содержащей ту же добавку [39]. Кроме того, концентрация лигносульфоната в жидкой фазе описанной системы (C3S—Н20 — добавка) в присутствии соды существенно выше. Эти результаты дают основание предполагать, что эффективность комбинированной содо-лигносульфонатной добавки обусловлена образованием ионных комплексов между ее составляющими [39]. Согласно [77], в смеси соды и лигносульфоната ^-потенциал
выше, чем при введении в исследуемую систему только одного лигносульфоната, особенно при концентрации менее 15 мг/мл.
По поводу механизма действия лигносульфонатов и других органических добавок-водо - понизителей на процессы гидратации C3S существуют четыре основные гипотезы [55, 56]. Первые три из них: адсорбция, пленкообразование (за счет высокодисперсных гидрат - ных фаз) и образование комплексных соединений — описаны ранее при рассмотрении гидратации С3А в присутствии этих добавок (см. разд. 3.3.1.3). Четвертая гипотеза связывает влияние введения органических подопонизителей на процессы гидратации C3S с их влиянием на образование центров кристаллизации [55, 56, 79].
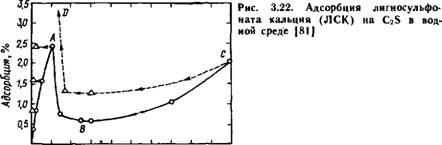
Адсорбционная гипотеза. Лигносульфонаты не сорбируются на C3S в неводных средах [81]. В системе C3S—Н2О — лигносульфонат найдено крутое возрастание величины сорбции лигносульфоната кальция при его концентрации до 1 мг/мл (рис. 3.22).
Это объяснено образованием значительных количеств C-S - Н-фазы с высокоразвитой удельной поверхностью при гидратации C3S в присутствии малых доз этого лигносульфоната [81]. С ростом концентрации лигносульфоната кальция с 1 до 3 мг/мл наблюдалось снижение сорбции этой добавки, поскольку уменьшилась степень гидратации C3S.
С последующим ростом дозировки лигносульфоната (выше 3 мг/мл) опять происходило некоторое повышение его адсорбции, хотя гидратация C3S существенно уменьшилась. По-видимому, этот эффект можно связать с большей дисперсностью частиц, на которых и происходила заметная адсорбция лигносульфоната кальция, или с прониканием молекул лигносульфоната в межслоевые пространства C-S-H - фазы [80]. Эти представления совпадают с высказ@нными в работе [79].
|
0 1234 5 6789 Начальная концентрация, г/л |
На десорбционных ветвях адсорбционно-десорбционных кривых в связи с низким уровнем концентрации можно констатировать практически пол
ную необратимость адсорбции, указывающую на то, что лигносульфонаты образуют с продуктами гидратации C3S прочные комплексы (см. рис. 3.22). Десорбция при исходной концентрации лигносульфоната мг/мл показывает, что при этом наблюдается лишь некоторая необратимость адсорбции, составляющая 1,5— 2 мг/мл; по-видимому, это количество лигносульфоната кальция образует поверхностный комплекс, в котором, кроме того, участвуют молекулярный водород и ионы, поставляемые гидратирующимся C3S.
|
Рис. 3.23. Изотермы адсорбции — десорбции лигносульфоната кальция (ЛСК) на полностью гидратированном C3S в водной среде [81] |
Как видно из рис. 3.22, при концентрации лигносульфоната кальция ниже 1,5—2 мг/мл наблюдается крутой подъем десорбционной ветви кривой. Следует, однако, иметь в виду, что этот подъем характерен лишь для десорбционной ветви, начинающейся при концентрации лигносульфоната кальция с' = 10 мг/мл, поэтому крутой подъем кривой при концентрации лигносульфоната 1,5—2 мг/мл можно приписать образованию C-S-H и СН, после чего гидратация C3S могла идти при меньшем содержании лигносульфоната кальция [81].
Это предположение согласуется с тем фактом, что в точках А и D на кривых рис. 3.22 зафиксировано образование C-S-H и СН-продук - тов гидратации C3S, тогда как в точках В и С эти гидратные новообразования с помощью ДТА не зафиксированы.
|
|
На рис. 3.23 представлены изотермы адсорбции — десорбции лигносульфоната кальция на пробах C3S, полностью гид - ратированного в бутылке [81]. Наблюдается крутой рост адсорбции лигносульфоната до его концентрации 0,5 мг/мл, сменяющийся более слабым увеличением адсорбции при повышении концентрации лигносульфоната кальция. Как видно из десорбционных кривых рис. 3.23, отмечается практически необратимая адсорбция тем большего количества лигносульфоната, чем выше его концентрация. Аналогичная тенденция прослеживается и на изотермах адсорбции из растворов диметилсульфоксида, однако с той разницей, что из водных сред при любой равновесной концентрации сорбируется больше лигносульфоната [81].
Согласно [81], это объясняется тем, что в водных средах лучше диспергированы частички и C-S-H, и СН, а это способствует прониканию лигносульфонатов в поверхность C-S-H-фазы. Тот факт, что лигносульфонаты не только хе - мосорбируются на поверхности C-S-H, но и образуют с ней поверхностные соединения, подтверждается наличием экзотермического эффекта на ДТА при 800 °С [81]. Рентгеновская дифрактометрия для этого случая непригодна, поскольку C-S-H не дает четких линий.
В водной фазе количество лигносульфоната, адсорбированного на СН, растет с концентрацией добавки. Это может быть следствием диспергирования частиц и соответственно возрастания физической адсорбции и химического взаимодействия лигносульфоната [81]. О необратимом характере процесса свидетельствуют сканирующие изотермы десорбции лигносульфоната, тогда как лишь частичная необратимость сорбции при повышенной концентрации лигносульфоната указывает на то, что имеет значение и его физическая адсорбция на СН-фа - зе. Эндотермический эффект при температуре 800 °С также подтверждает факт химической реакции между некоторой долей СН и лигносульфоната кальция [81]. 124
Описанные ранее результаты свидетельствуют о том, что лигносульфонаты адсорбируются не на C3S, а на продуктах его гидратации, например на C-S-H и СН. Таким образом, как и для СзА, представления об адсорбции лигносульфонатов на C3S как о причине их замедляющего гидратацию действия должны быть изменены в пользу адсорбции этих органических добавок на гидратных новообразованиях.
Согласно [81], влияние лигносульфонатов на гидратацию C3S определяется, главным образом, их концентрацией в жидкой фазе, а не соотношением между ними и C3S. По-видимому, торможение гидратации C3S в раннем периоде обеспечивается при концентрации лигносульфоната выше 2,5 мг/мл. Замедляющее действие лигносульфонатов связано со стабилизацией поверхностного комплекса, включающего поверхность продуктов гидратации C3S, лигносульфо - нат и воду, причем стабильность этого комплекса тем выше, чем больше концентрация лигносульфоната в жидкой фазе [81].
Согласно этим представлениям, гидратация C3S может начаться после того, как уровень концентрации лигносульфоната снизится вследствие его адсорбции на C-S-H и СН, причем за счет гидратации C3S достаточно образования даже малых количеств этих фаз.
Предложенная гипотеза, однако, не может быть непосредственно применена к объяснению эффекта от совместного введения в исследуемую систему лигносульфоната и Na2C03.
Осаждение. Этот механизм аналогичен рассмотренному ранее при гидратации СзА в присутствии органических добавок (см. разд. 3.3.1.3); поскольку через некоторое время C3S поставляет в раствор те же Са2+-ионы, что и СзА, постольку должны образовываться те же труднорастворимые кальциевые соли органических водопонизителей [64]. Однако из этого обстоятельства вытекает, что для систем типа C3S—СзА—Н20 действие органически хдобавок — замедлителей гидратации C3S должно' относительно слабо зависеть от отношения СзА к C3S, тогда как известно, что в действительности замедляющее гидратацию C3S действие этих добавок возрастает с уменьшением отношения С3А к C3S [55, 56, 80, 81].
Образование комплексных соединений. В момент контакта C3S с водой в раствор поступают кальций - и силикат-ионы. Добавки-замедлители, такие, как сахароза или винная кислота, повышают концентрацию силикат-ионов в жидкой фазе системы C3S — Н20, тогда как янтарная кислота, не замедляющая гидратацию C3S, практически не изменяет концентрации этих ионов. Это можно объяснить образованием комплексных соединений с участием Са2+-ионов, что приводит к снижению их концентрации, не препятствуя растворению C3S и соответственно росту концентрации силикат-ионов [79]. Повышение величины оптического вращения раствора глюко - ната можно приписать образованию в жидкой фазе комплексных соединений [69], а их осаждение на частицах C3S рассматривать как причину снижения этого показателя. Предположено образование комплексов, включающих неорганические силикат - и кальций - ионы совместно с гидроксил - и карбоксилатными ионами добавок. Могут быть образованы комплексы между Са + и органическими водопонизителями, такими, как глюконовая кислота и сахара [83, 84]. Комплексы в растворе способны понизить концентрацию кальций-ионов в жидкой фазе и уменьшить рост кристаллов СН, благодаря чему обеспечивается замедляющий эффект этих добавок [79]. Комплекс между глюконатом и Са2+ имеет константу устойчивости около 16. Однако в ряде случаев комплексообразо - вание в растворе не может считаться главным фактором торможения процессов гидратации C3S из-за низкой константы устойчивости этих комплексов и невозможности с их помощью сильно понизить уровень концентрации кальций - ионов в жидкой фазе [55, 83, 84].
Зародышеобразова - н и е. Во время индукционного периода, следующего за начальным коротким периодом интенсивной гидратации C3S, контролирующим фактором процесса становится диффузия кальций-ионов от поверхности C3S в объем жидкой фазы, что приводит к увеличению концентрации Са2+ [56]. Экранирование C3S частицами C-S-H может создавать барьер для диффузии кальций-ионов [85].
Согласно гипотезе, выдвинутой в работе [55] и развитой в работе [56], силикат-ионы адсорбируются на зародышах кристаллизации СН и подавляют их рост, поэтому для компенсации указанного эффекта требуется сильное пересыщение относительно Са(ОН)г. Кристаллизация СН и C-S-H начинается лишь к концу индукционного периода гидратации C3S, когда достигается определенное пересыщение.
Согласно этой теории, любые вещества, тормозящие образование зародышей и рост СН, будут выступать в качестве добавок-замедлителей. Эти эффекты органических веществ могут быть приписаны их способности образовывать хелат - ные соединения с кальцием на зародышах кристаллизации СН. Действительно, большинство органических добавок-замедлителей обладает выраженной склонностью к хелатообра - зованию [56]. Найдено также, что органические добавки снижают число кристалликов СН в гидратирующейся водной пасте C3S [86].
Лигносульфонаты тормозят рост кристаллов СН при их невысокой дозировке [39]. Если же их концентрацию повысить, то рост кристаллов подавляется полностью. Поэтому замедление лигносульфона - тами гидратации C3S можно объяснить торможением ими стадии роста кристаллов СН— движущей силы процесса на ранней стадии взаимодействия C3S с водой. В присутствии эффективных замедлителей их влияние можно связать с образованием относительно большого количества аморфных высокодисперсных частиц СН вследствие снижения размера растущих кристаллов СН.
Как известно [87], такие анионы, как глюконат-ионы, сорбируются на положительно заряженных частицах C-S-H, следовательно, подобные добавки влияют на образование не только зародышей СН, но и игольчатых частиц C-S-H. Поэтому в их присутствии может подавляться поступление в раствор как Са2+, так и силикат-ионов, что обеспечивает замедление процесса гидратации C3S (см. рис. 3.20). В работах [89, 91] найдено, что добавление относительно больших доз спиртов, например метанола, этанола и пропанола, приводит к удлинению индукционного периода и к снижению степени гидратации CjS в период ускорения.
Авторы объясняют замедляющее действие добавок снижением ими коэффициента диффузии Са-ионов, поступающих в жидкую фазу вследствие растворения C3S, и адсорбцией молекул спиртов на поверхностях частиц СН и C-S-H.
Ими отмечено также, что спирты приводят к существенному изменению морфологии C-S-H и тормозят зародышеобразова - ние этой фазы. Таким образом, по-видимому, неизменяющиеся в ходе процесса органические молекулы, например спирты, подавляют стадию образования зародышей C-S-H.
3.3.1.7. Влияние добавок во- допонизителей-замедлителей на процессы гидратации C3S в присутствии СзА. Адсорбция лигносульфонатов на продуктах гидратации C3S так же важна, как и на продуктах гидратации СзА, и протекает по той же схеме (см. рис. 3.11 и 3.23). Однако в результате гидратации СзА из жидкой фазы адсорбируется большее количество лигносульфонатов, чем при гидратации C3S, что может быть обусловлено более быстрым протеканием процесса гидратации. Поэтому в системе C3S—С3А—Н2О в результате гидратации СзА может происходить снижение содержания лигносульфонатов [27, 31, 77, 80, 81].
На рис. 3.24 представлены термограммы, снятые для пасты, состоящей из 80 % C3S и 20 % СзА, в присутствии 0,3 % лигносульфоната натрия (ЛСН), не содержащего Сахаров. Как видно, в отличие от действия 0,3 % ЛСН в отсутствие С3А, где он полностью тормозил гидратацию C3S в течение 14 сут (см. рис. 3.19), в исследуемой системе C3S— СзА—Н20 —0,3% ЛСН гидратация C3S тормозится в течение всего 1 сут [77]. В более
Поздние сроки, в частности через 14 сут, количество C-S-H и СН в этой системе практически такое же, как в пробах без добавки ЛСН. Не обнаружено существенной разницы и в составе продуктов гидратации СзА, за исключением того, что степень гидратации этой фазы в течение первых часов, по-видимому, несколько возрастает, тогда как превращение гексагональных гидроалюминатов кальция в СзАНб кубический слегка замедляется (см. рис. 3.24). Таким образом, введение СзА нарушает сильное торможение лигносульфоната - ми процессов гидратации C3S [27, 31, 81]. С ростом дозировки ЛСН (0,5—1 %) и снижением количества С3А его гидратация, в том числе и в присутствии C3S, может быть замедлена на более длительный период времени, чем это наблюдается на рис. 3.24.
С ростом концентрации ЛСН с 0,3 до 0,9 % в системе, содержащей 80% C3S + 2O % СзА, гидратация C3S затормаживается до 1 сут, тогда как скорость гидратации С3А не изменяется сколько-нибудь существенно — за исключением слабого замедления в течение первых 30 мин. Это свидетельствует о том, что чем выше отношение количества лигносульфоната к С3А, тем слабее способен С3А противодействовать тормозящему влиянию лигносульфоната на гидратацию C3S.
Этот механизм противодействия С3А гидратации C3S подтверждается тем, что введение добавки лигносульфоната в алит состава C54S16AM, содержащий 3—4 % СзА, приводит к менее сильному торможению гидратации C3S, чем*- введение такого же количества лигносульфоната в чистый C3S или в C302M10S101A2, практически не содержащий СзА [80].
При введении в C3S 5 % трехкальциевого алюмината, предварительно гидратирован - ного в течение 5 мин до его смешения с алитом, или при замене С3А гексагональными гидроалюминатами кальция нарушение ими тормозящего действия лигносульфоната на гидратацию C3S будет ниже, чем при добавлении 5 % СзА. Введение кубического СзАНб оказывается практически неэффективным способом противодействия тормозящему влиянию лигносульфонатов на гидрата - цйю C3S [31, 81]. Эти результаты со всей очевидностью свидетельствуют о том, что относительное количество лигносульфоната, адсорбированного алюминатными фазами в водной среде, располагается в следующий уменьшающийся ряд: С3А> С4АН, з> С2АН8> > С3АНб (см. разд. 3.3.1.1), причем эта адсорбция должна быть признана в качестве контролирующего фактора при оценке влияния лигносульфонатов на процессы гидратации C3S в исследуемой системе [31, 81].
Действие на процессы гидратации C3S комбинированной добавки, состоящей из 0,3 % ЛСН+ 0,3 % Na2C03, на систему 80 % C2S + 20 % СзА примерно такое же, как и одного ЛСН (0,3 %), за исключением того факта, что введение этой комбинированной добавки тормозит гидратацию обеих фаз — C3S и СзА — в течение не менее 30 мин (см. рис. 3.24), причем с увеличением дозировки ЛСН и Na2C03 до 0,9 % индукционный период гидратации обоих мономинералов—C3S и СзА — возрастает до 1 сут [77].
Действие других органических добавок-водопонизителей, таких, как глюкоза и. глюконат натрия, на систему 80 % C3S + + 20 % С3А подобно рассмотренному ранее влиянию лигносульфонатов, за исключением того факта, что глюконат натрия обладает большим тормозящим гидратацию C3S эффектом [92).
Эффект от добавления чистого ЛСН (без Сахаров), глюкозы и глюконата натрия на гидратацию C3S в системе 77% C3S + 19% СзА - f 4% CaS04-2H20 виден из анализа ДТГ (рис. 3.25). Глюконат и глюкоза стабилизируют эттрингит, затормаживая его превращение в моносульфоалюминат кальция, хотя образование эттрингита на ранней стадии реакции (до 6 ч), по-видимому, ускоряется. Образование СН замедляется при введении 0,3% лигносульфоната или глюконата натрия до 1 сут, а при добавлении 0,3 % глюкозы — до 3 сут. Таким образом, влияние описанных добавок на процессы гидратации C3S в отсутствие С3А и гипса (см. рис. 3.19 и 3.20) проявляется в большей степени, чем при их наличии в системе (см. рис. 3.25), поскольку продукты их взаимодействия — эттрингит и моносульфоалюминат кальция С3А • CaS04 • 12Н20 — сорбируют добавки и снижают их воздействие на гидратацию C3S. По тормозящему гидратацию C3S действию рассмотренные добавки можно расположить в следующий нисходящий ряд: глюкоза> глюконат натрия> лигносульфонат натрия. Этот эффект может быть следствием как влияния перечисленных добавок на степень гидратации C3S (см. разд. 3.3.1.6), так и уводом части добавок, адсорбированных эттрингитом и C3A-CaS04- 12Н20.
3.3.1.8. Влияние добавок водопонизителей-замедлителей на процессы гидратации C2S. Введение 0,125 % салициловой кислоты тормозит процесс гидратации C2S при большом водо - твердом отношении [35]. Тех-
5 Зак. 976 нический лигносульфонат кальция в той же дозировке обладает большим замедляющим действием", в его присутствии в течение 7 сут не протекает сколько-нибудь заметная гидратация C2S, а рекристаллизация СН в виде гексагональных пластинок тормозится вплоть до 30 сут [35].
Авторы работы [92] обнаружили, что хотя свободный от Сахаров лигносульфонат натрия при концентрации 0,3 % тормозит гидратацию C2S, он уступает по эффективности техническому лигносульфонату натрия. Лигносульфонаты сильнее замедляют процессы гидратации C3S, чем C2S (см. рис. 3.21, 3.26).
Воздействие на процесс гидратации C2S смеси, состоящей из 0,3 % лигносульфоната натрия (ЛСН) +0,3% Na2C03, значительно слабее, чем действие одного ЛСН (см. рис. 3.26); влияние этой смеси на гидратацию C2S аналогично ее влиянию на гидратацию C3S.
Найдено [122], однако, что при добавке в пасту из C2S смеси 1 % ЛСН +1 % Na2C03 ее текучесть возрастает больше, чем при добавке только ЛСН.
3.3.1.9. Влияние добавок водопонизителей-замедлителей на процессы гидратации C2S в присутствии С3А.
Результаты работы [92] свидетельствуют, что добавка 0,3 % лигносульфоната натрия (ЛСН) значительно слабее тормозит процессы гидратации C2S в присутствии 20 % С3А,
129
|
Рис. 3.25. Влияние 0,3 % раствора не содержащего Сахаров лигносульфоната иа трия (ЛСН), глюкозы (Г) и глюконата натрия (ГН) на гидратацию смеси, состоя щей из 76 % CiS + 19 % СзА+ 5 % гипса (данные ДТГ) [92) Е — эттрингит; М — моносульфоалюминат кальция, СН — гидроксид кальция; G — гель CSH |
Чем в отсутствие трехкальцие - вого алюмината (рис. 3.27). Это может быть следствием того, что при гидратации СзА снижается концентрация J1CH в водном растворе. Подобные результаты получены и для системы C3S—С3А—НгО (см. разд. 3.3.1.7).
Смесь из 0,3% ЛСН + + 0,3Na2C03 замедляет гидратацию C2S в присутствии С3А в меньшей степени, чем один ЛСН в той же дозе, причем их эффект отличается от полученного при гидратации C3S в отсутствие С3А (см. рис. 3.26). Более высокие дозы ЛСН и Na2C03 (0,9 % + 0,9 %) соответственно тормозят процессы гидратации C2S на больший срок (см. рис. 3.27). В системе C2S—СзА—НгО гидратация С3А тормозится смесью 0,3% ЛСН+ 0,3% Na2C03 всего в течение 30 мин, тогда как при повышении дозировки каждого из компонентов этой смеси до 0,9 % — в течение 1 сут [92].
3.3.1.10. Влияние лигносульфонатов на процессы гидратации портландцемента. В этих случаях следует учитывать воздействие одних компонентов портландцемента на процессы гидратации других компонентов. Так, влияние добавок на процесс гидратации портландцемента зависит от его состава и прежде всего от содержания С3А, щелочей и сульфатов; имеют значение, кроме того, величина удельной поверхности цемента, а также состав, молекулярная масса, дозировка лигносульфонатов и содержание в них Сахаров. Поскольку перечисленные выше характеристики цемента и добавок нередко отсутствуют в литературных источниках, трудно объяснить причины расхождений в результатах исследований, проводимых разными авторами, казалось бы, в близких условиях.

|
Сн,% |
|
3 7 74 21 28 t сут |
|
Рис. 3.26. Влияние ЛСН и ЛСН + кар - бонат натрия на кинетику гидратации C2S |
|
1 — эталон; 2 — 0,3% ЛСН, 3 — 0,3% ЛСН + +0,3 % карбоната натрия СН,%
0,5 3 9 1 3 7 74 21 28t ц сут Рис. 3.27. Влияние ЛСН и ЛСН + +карбонат натрия на кинетику гидратации C2S в присутствии 20 % СзА |92] / — эталон; 2 — 0,3% ЛСН; 3—0,3% ЛСН + +0,3% соды; 4 — 0,9% ЛСН+0,9% соды |
В целом можно сделать общие выводы относительно действия лигносульфонатов в
|
Рис. 3.28. Влияние технического лигносульфоната (0,2—0,3 %) на кинетику гидратации (степень гидратации) портландцемента, сроки его схватывания и прочность образцов / — без добавки; 2 — с добавкой; / — начало схватывания (слабое ускорение); II—конец схватывания (существенное замедление); 111 — ранняя прочность (умеренное замедление); IV— прочность в более позднем возрасте (слабое ускорение) |
Обычной дозировке, т. е. 0,2— 0,3 % массы цемента при одинаковом водоцементном отношении:
А) они не намного удлиняют или незначительно сокращают сроки до начала схватывания цемента (в зависимости от их состава и состава цемента);
Б) они замедляют продолжительность периода до конца схватывания цемента и нарастание прочности цементных материалов в ранние сроки;
В) они несколько повышают прочность растворов и бетонов в более поздние сроки твердения.
На рис. 3.28 изображены результаты действия технического лигносульфоната на процессы гидратации, сроки схватывания цемента и прочность образцов из него.
А. Начало схватывания или очень ранняя стадия гидратации цемента. Введение лигносульфоната натрия в цементные материалы приводит к ускорению процесса гидратации СзА в соответствии с уравнением (3.3) при отсутствии СН, поскольку эта добавка тормозит выделение Са(ОН)г при гидратации C3S [50]; кроме того, при высоком содержании щелочей понижается растворимость СН (см. разд. 3.3.1.7).
Авторы работы [8] обнаружили, что при введении в цемент с высоким содержанием щелочей (1,2 % КгО + З % Na20) 0,2 % технического лигносульфоната кальция (в составе этой добавки присутствовали сахара) наблюдалось ускорение гидратации СзА и торможение гидратации C3S в течение 2—3 ч (табл. 3.9).
Таблица 3.9. ГИДРАТАЦИЯ ПОРТЛАНДЦЕМЕНТА (C3S=60 % СзА =6 %) С ДОБАВКОЙ 0,2 % ТЕХНИЧЕСКОГО ЛИГНОСУЛЬФОНАТА КАЛЬЦИЯ (ЛСК) И БЕЗ ДОБАВКИ fSf
|
Время, ч |
Относительная интенсивность дифракционного максимума |
|||
|
C3S |
С3А |
|||
|
Без добавки |
С ЛСК |
Без добавки |
С ЛСК |
|
|
0 |
100 |
100 |
100 |
100 |
|
2 |
95 |
100 |
90 |
80 |
|
12 |
75 |
90 |
30 |
75 |
|
24 |
60 |
70 |
20 |
60 |
|
72 |
50 |
40 |
10 |
50 |
|
Примечание. В цементах содержалось 1,2% КгО и 0,3% Na20. |
Если принять во внимание, что поведение C4AF аналогич
но поведению СзА, а степень гидратации C2S в течение первых нескольких часов пренебрежимо мала, то можно заключить, что добавление лигносульфоната может сократить сроки начала схватывания при высоком отношении алюминатных фаз цемента к C3S и удлинить эти сроки при низком отношении этих фаз (табл. 3.10).
Таблица 3.10. ВЛИЯНИЕ ДОБАВКИ 0,2% ЛСК НА СРОКИ СХВАТЫВАНИЯ ПОРТЛАНДЦЕМЕНТА С РАЗНЫМ ОТНОШЕНИЕМ (ПО МАССЕ) АЛЮМИНАТНЫХ ФАЗ К C3S )8|
Конец схватывания, мин
Без добавки
351
2+11,5 70
3+11 61
6+8,5 60
315
В исследовании [93] отмечено, что в присутствии 0,28 % лигносульфоната кальция (свободного от Сахаров) не происходит обычно наблюдаемого торможения гипсом процесса гидратации С3А. Соответственно этому в таких цементных материалах наблюдается и большее тепловыделение, чем в аналогичных системах в отсутствие подобной добавки [93, 94].
В отличие от этого в работе [28] обнаружено, что свободные от Сахаров лигносульфонаты кальция и натрия замедляют сроки начала схватывания цемента. По-видимому, эти
Различия объясняются тем, что в работе [28] использован низкощелочной портландцемент и лигносульфонат кальция с примесью Сахаров, а в работах [93, 94] — не содержащий Сахаров лигносульфонат с добавкой — ускорителем схватывания.
Технический J1CK. в больших дозах (0,3—0,5 %) способен обеспечить быстрое схватывание цемента, что можно объяснить наличием в ЛСК Сахаров [28], поскольку тот же лигносульфонат кальция и в той же дозировке, но не содержащий Сахаров, не вызывает сильного сокращения сроков схватывания цемента.
Вместе с тем быстрое схватывание наблюдается при использовании добавок на основе углеводов [50, 95]. Ускорение процесса гидратации цемента в очень ранние сроки, наблюдаемое иногда при использовании цементов с высоким содержанием щелочей в присутствии нормальных дозировок технического или свободного от Сахаров лигносульфоната [93, 94], можно объяснить в соответствии с разд. 3.3.1.2 и 3.3.1.7; этот механизм отличен от того, который приводит к быстрому схватыванию при введении нормальных доз углеводов [50, 95] или высоких доз лигносульфоната кальция, содержащего сахара (см. разд. 3.3.1.4 и 3.3.1.12).
Введение добавок через некоторое время после затворения цемента приводит к снижению сорбции добавки и к исключению ускорения процес
са в ранние сроки [74]. В результате повышенная концентрация добавки, содержащейся в жидкой фазе, обеспечивает более сильное замедление процессов гидратации цемента на всех стадиях, чем при введении этой же добавки с водой затворения [50].
Описано несколько случаев ненормально ранней потери подвижности цементных смесей с водопонижающими добавками [22, 96, 97], которые могут быть обусловлены двумя разными причинами: а) ускорением ранней стадии гидратации СзА, протекающей согласно уравнению (3.3) и приводящей к ложному схватыванию; б) замедлением выпадения гипса, что способствует ложному схватыванию цемента, который до введения добавки лигносульфоната характеризовался нормальными сроками схватывания. Следует отметить, однако, что в случае ложного схватывания цемента без добавки это явление не удается устранить перемешиванием и поэтому для борьбы с ним необходимо вводить повышенное количество гипса. В отличие от этого потерю подвижности, вызванную ложным схватыванием из-за присутствия лигносульфоната, удается ликвидировать путем последующего перемешивания смеси.
Автор [97], исследовавший множество партий цемента с ненормальными сроками схватывания, с добавками лигносульфонатов, гидроксикарбоно - вых кислот и без добавок, разделил эти цементы в зависимости от влияния добавок на четыре группы:
1. Цементы с нормальными сроками схватывания в отсутствие добавок и ложным схватыванием при введении 0,3 % добавки. Автор полагает, что добавки увеличивают количество эттрингита в сроки от 3 до 20 мин; это и приводит к ложному схватыванию.
2. Цементы с ложным схватыванием в отсутствие добавок и с нормальными сроками схватывания при введении 0,3 % добавки. В этом случае в присутствии добавки не происходит никаких существенных изменений в процессах рекристаллизации гипса или образования эттрингита в сроки от 3 до 20 мин. Ложное схватывание, связанное с природой тиксотропных явлений, можно объяснить взаимодействием между противоположно заряженными поверхностями зерен цемента, вызванным аэрацией. Адсорбция добавок приводит к образованию одноименно заряженных поверхностей всех фаз цемента и соответственно исключает ложное схватывание.
3. Цементы, характеризующиеся ложным схватыванием при наличии добавок и без них. Без добавок ложное схватывание вызывает преимущественно полугидрат сульфата кальция, выкристаллизовывающейся в двугидрат, хотя эттрингит образуется между 3 и 20 мин. В присутствии добавок одновременно с кристаллизацией гипса образуется большее количество эттрингита.
4. Поведение цементов четвертой группы в основных чертах сходно с поведением цементов третьей группы, за исключением того факта, что при введении в них добавок гипс не выкристаллизовывается, по-видимому, из-за быстрой реакции S04-hohob из раствора с образованием эттрингита.
Б. Конец схватывания или ранняя гидратация цемента (до 1 сут). За очень ранним периодом гидратации цемента (2—3 ч), в течение которого присутствие лигносульфонатов может либо ускорять, либо замедлять процесс, обычно следует существенное замедление вплоть до одних суток. Как видно из табл. 3.9, лигносульфонаты в течение этого срока сильно тормозят гидратацию как C3S, так и СзА, а также замедляют поэтому продолжительность схватывания цемента (см. табл. 3.10). В работах [28, 93, 94] найдено, что торможение раннего периода гидратации цемента вызывают и технический, и не содержащий Сахаров лигносульфонаты, причем их замедляющее действие пропорционально дозировке этих добавок, вводимых в количестве 0,1—0,5 % массы цемента. Это можно объяснить влиянием лигносульфонатов на гидратацию СзА в присутствии гипса (см. разд. 3.3.1.2). Как только образуется эттрингит, он адсорбирует большое количество молекул органических веществ и соответственно тормозит гидратацию С3А вследствие замедления превращения эттрингита в моносульфоалю - минат кальция [28, 30]. В дополнение к этому концентрация лигносульфоната в жидкой фазе остается на таком уровне, что одновременно тормозится гидратация и C3S (см. разд. 3.3.1.6 и 3.3.1.2). В результате замедляются не только сроки схватывания цемента, но и ранняя прочность образцов в возрасте 1 сут (см. рис. 3.28).
В присутствии 0,14—0,28 % лигносульфоната натрия, не содержащего Сахаров, степень гидратации обычного портландцемента (тип I) в период между 3—4 ч и 1—2 сут меньше, чем низкоалюминатного цемента (тип V) [94]. Это объясняется большей адсорбцией добавки, поскольку в цементе типа I выше содержание СзА (см. разд. 3.3.1.1 и 3.3.1.2); в результате в жидкой фазе остается меньше лигносульфоната для воздействия на гидратацию C3S (см. разд. 3.3.1.7). Эти данные объясняют, почему добавки-водопонизители обеспечивают лучшую подвижность и более длинные сроки схватывания составов на цементах с низким содержанием СзА и щелочей [98].
Особенно сильное замедление сроков схватывания цементов с низким содержанием и СзА и гипса в присутствии лигносульфонатов [99—101] может быть объяснено недостаточным количеством сульфатов для торможения вредного действия ферритной фазы на эти процессы, а также на раннюю прочность цементных материалов [97]. В отсутствие органических добавок C4AF реагирует с гипсом, образуя богатый железом эттрингит, поэтому такие цементы имеют нормальные сроки схватывания. В случае недостаточного содержания гипса при гидратации C4AF выделяется гель гид- роксида железа (III), отлагающийся на C3S и C2S и сильно замедляющий и их сроки схватывания, и раннюю прочность образцов [102]. По-видимому, лигносульфонаты замедляют образование богатого железом эттрингита, способствуя формированию геля гид - роксида железа [97].
Согласно [103], сильное удлинение процессов гидратации клинкера при наличии и в отсутствие лигносульфоната в большей степени обусловлено реакцией самой феррит - ной фазы, чем торможением гидратации C3S.
Альтернативная гипотеза основывается на меньшей адсорбции лигносульфоната на гид - ратирующемся C4AF, чем на С3А [45, 50] (см. разд. 3.3.1.5), поэтому в жидкой фазе остается больше добавки и она более эффективно тормозит гидратацию C3S (см. разд. 3.3.1.6).
Очень сильное торможение процессов гидратации и сроков схватывания цементов с низким содержанием гипса и СзА при введении лигносульфонатов можно предотвратить, добавляя дополнительное количество гипса при производстве цемента и (или) путем снижения дозировки лигносульфоната при производстве бетона [93]. Низкощелочные цементы также могут иметь чрезвычайно удлиненные сроки схватывания и сильно растянутые во времени процессы гидратации, поэтому в составы с такими цементами необходимо вводить меньше лигносульфоната.
По данным [8], суточная прочность образцов из раствора на портландцементе при заданном постоянном водоце - ментном отношении снижается при введении 0,2 % технического лигносульфоната (рис. 3.29), что согласуется с результатами работы [93].
Вместе с тем степень гидратации цементов с высоким содержанием гипса в этом возрасте с помощью лигносульфоната не удается затормозить сколько-нибудь существенно [93]; это можно объяснить меньшей эффективностью лигносульфонатов в качестве замедлителей гидратации в системе: С3А — гипс — НгО (см. разд. 3.3.1.2), чем в системе С3А—Н20 (см. разд. 3.3.1.1).
В. Более поздняя гидратация в сроки свыше 1 сут. Как видно из данных табл. 3.9, через 72 ч интенсивность пиков C3S на дифрактограммах проб цементов с добавками лигносульфоната слабее, чем в пробах без добавок. Эти результаты свидетельствуют о том, что гидратация C3S в присутствии СзА или СзА + гипс при введении лигносульфоната тормозится только в начальный период; в дальнейшем же, вследствие адсорбции на продуктах гидратации СзА больших
количеств лигносульфоната, его концентрация в жидкой фазе становится столь малой, что она уже не в состоянии замедлить образование зародышей C-S-H и СН. Поэтому облегчается гидратация C3S, по-видимому, вследствие диспергирования добавкой частиц цемента (см. разд. 3.3.1.6). Продолжительность периода, после которого замедляющее действие лигносульфоната на гидратацию C3S сменяется ускоряющим действием, зависит от состава и дозировки этой добавки, а также от удельной поверхности и химико-минералогического состава цемента: у цементов с низкой удельной поверхностью смена замедляющего действия добавки на ускоряющее наблюдается гораздо позднее, чем у более дисперсного цемента, в частности в присутствии относительно высоких доз технического лигносульфоната. Для обычного портландцемента количество не- испаряемой воды в присутствии 0,28 % лигносульфоната вначале снижается по сравнению с контрольными пробами (без добавок), но затем через 2— 3 сут оно выше, чем у контрольных проб.
При использовании низко - алюминатного цемента этот момент превращения добавки лигносульфоната из замедлителя в ускоритель гидратации цемента наступает лишь после 10 сут [12, 94, 104]. Кинетике гидратации цемента соответствуют данные прочности образцов в поздние сроки, что схематически изооражено на рис. 3.29 [8]. Как видно, после трех суток прочность цементно-песчаного раствора на сжатие и изгиб при постоянном В/Ц выше в тех образцах, в которые при затво - рении вводили 0,2 % лигносульфоната, чем в контрольных образцах без добавок.
|
Ran, МПа |
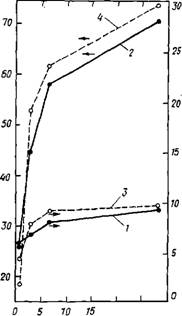
|
RU3Z, Mna |
|
20 25 t, cym |
|
Рис. 3.29. Кинетика изменения прочности при сжатии Ясж и изгибе Яизг раствора при постоянном В/Ц=0,5 без добавки (/, 2) и с добавкой 0,2 % технического лигносульфоната (3, 4) [81 |
Аналогичные результаты получены при использовании обычного и низкоалюминатного цементов (оба с относительно высокой удельной поверхностью— примерно 450 м/кг). При этом для образцов из низкоалюминатного цемента наблюдалось снижение прочно
сти при сжатии в возрасте 1 и 3 сут. Однако иногда введение лигносульфоната не приводит к росту прочности образцов в более позднем возрасте вследствие их воздухововлека - ющего эффекта [105].
Добавки лигносульфонатов не вызывают сколько-нибудь существенного изменения морфологии и микроструктуры цементного камня; правда, структура становится несколько более плотной вследствие диспергирующего действия этих добавок на зерна цемента •[106, 107]. Об этом свидетельствуют и данные [105].
3.3.1.11. Влияние смеси лиг- носульфонатно-карбонатных добавок на процессы гидратации портландцементного клинкера или портландцемента. Вопросы совместного действия 0,5—1 % лигносульфоната +0,5 — 1 % карбоната или бикарбоната щелочного металла на порт- ландцементный клинкер (не содержащий гипса) были предметом многочисленных исследований [108—113]. При этом обнаружено существенное понижение подобными добавками водоцементного отношения, хотя прочность образцов в возрасте 28 сут была несколько ниже, чем у эталона [112]. Введение таких добавок в комбинации приводит к значительному понижению прочности цементных материалов, особенно при повышенной дозировке лигносульфоната [112].
Нарастание прочности бетона в присутствии смеси этих добавок замедляется столь значительно, что даже при В/Ц = = 0,26 требуется его тепло - влажностная обработка [114]. Это можно объяснить тем, что смеси указанных добавок ослабляют связь между продуктами гидратации вяжущего и заполнителем [114]. Как следствие, смеси лигносульфоната и карбоната щелочных металлов практически не применяются.
Вместе с тем комбинация этих добавок предотвращает ложное схватывание составов на портландцементном клинкере и сильно увеличивает текучесть смесей при неизменном В/Ц [108]. Установлено также [113], что эти добавки контролируют сроки схватывания без сколько-нибудь существенного изменения степени гидратации клинкера и, в частности, С3А в нем. По данным [32, 34], комбинация этих добавок замедляет гидратацию чистого С3А, но не ухудшает индукционный период гидратации С3А в твердом растворе С3А—Na20 (см. рис. 3.10). Это различие относится и к портландцементному клинкеру, содержащему твердый раствор С3А—Na20 [113].
Сходные результаты получены при изучении влияния гипса на гидратацию чистого С3А [115] и С3А в виде твердого раствора СзА—Na20 в присутствии указанных добавок [35]. По-видимому, гипс при этом тормозит гидратацию чистого С3А, но не влияет существенным образом на степень гидратации С3А в его твердом растворе С3А—Na20, что и наблюдается в портландцемент - ном клинкере. Согласно [113], лигносульфонатно-карбонатная добавка влияет на сроки схватывания клинкера благодаря реакции с его поверхностью и таким образом предотвращает слипание частиц клинкера и соответственно потерю пластичности смеси.
Аналогичный механизм для объяснения влияния гипса на сроки схватывания портландцемента в присутствии этих добавок предложен и в исследовании [116]. Смесь лигносульфоната и карбоната натрия вызывает диспергирование частиц клинкера. Совместное воздействие лигносульфоната и карбонатов щелочных металлов Оказывает существенное влияние на изменение процессов гидратации также обычного портландцемента (т. е. клинкера в присутствии гипса). При этом наблюдаются три температурных пика, разделенных двумя индукционными периодами, что было объяснено образованием сильно анионактив - ного комплекса лигносульфоната с СОз~, обладающего большим диспергирующим действием, чем исходный лигносульфонат. Отмечено, что в присутствии ЫагСОз концентрация лигносульфоната в жидкой фазе цементной пасты намного выше, чем в отсутствие Na2C03 [99].
Точные, ясные представления о механизме действия смеси добавок лигносульфоната и карбоната щелочных металлов на процессы гидратации порт - ландцементного клинкера и цемента, а также об их разжижающем эффекте до сих' пор отсутствуют.
3.3.1.12. Влияние на процессы гидратации портландцемента других добавок водопонизителей-замедлителей. О р - ганические вещества. Эффект от введения оксикислот, например глюконовой, и углеводов, например глюкозы и сахарозы, на процессы гидратации портландцемента очень схож с типовым для лигносульфонатов (см. разд. 3.3.1.11), хотя для получения сопоставимого результата нужны разные дозировки сравниваемых добавок.
В основном эти водопонизители тормозят как очень раннюю, так и раннюю стадии гидратации цемента (начало схватывания и конец схватывания, а также прочность образцов суточного возраста) и вместе с тем увеличивают степень гидратации цемента в более поздние сроки. Однако в отдельных случаях оксикислоты и углеводы могут ускорить и очень раннюю стадию гидратации цемента, что приводит к его быстрому схватыванию и раннему загустеванию смеси.
А. Очень ранняя гидратация (начало схватывания). Найдено, что при одинаковой дозировке добавки глюконата натрия, лимонной кислоты и отчасти сахарозы лучше замедляют начало схватывания цемента, чем лигносульфонат кальция, салициловая кислота, геп - тонат и борогептонат натрия. Известно, что замедляющую способность органических водопонизителей определяет содержание алюмината и сульфата в цементе.
Определено, что гидроксикарбоновые кислоты удлиняют сроки схватывания низкощелочных и низкоалюминатных цементов сильнее, чем цементов с более высоким содержанием СзА и щелочей (табл. 3.11). Аналогичные эффекты обнаружены при исследовании тепловыделения при гидратации этих цементов: высокощелочные приводят к снижению концентрации Са(ОН)г в жидкой фазе, а высокоалюминатные — к уменьшению концентрации добавки вследствие ее большей адсорбции на продуктах гидратации алюминатов. Результат от обоих перечисленных эффектов — уменьшение замедляющего действия гидроксикарбо - новых кислот на процессы гидратации СзА и C3S.
Таблица 3.11. сроки схватывания цемента и загустевание раствора из бетонной смеси при наличии
Гидроксикарбоновых кислот
И в отсутствие добавок (98]
|
Тип цемента |
Щелочи (в пересчете на N а гО), % |
Добавка, мл/кг Цемента |
Начало вания, |
Схваты- ч—мин |
|
Цемента* |
Раствора из Бетонной сме - с и' |
|||
|
А |
0,87 |
7 |
6—30 |
|
|
А |
0,87 |
2,78 |
12 |
9—24 |
|
А |
0,87 |
3,48 |
17 |
11—00 |
|
В |
0,56 |
— |
7 |
6—Об |
|
В |
0,56 |
2,78 |
25 |
9—54 |
|
В |
0,56 |
3,48 |
49 |
12—12 |
|
* Определено с помощью иглы Вика. ** Определено по методу Проктора путем мокрого отсева раствора из бетонной смеси (размер зерен заполнителя не более 19 мм) через сито № 4. |
Быстрое схватывание наблюдалось в опытах с белым цементом (с низким содержанием гипса) и с добавками углеводов [95]. Аналогичные результаты получены и при использовании высокощелочного цемента типа III в присутствии сахара [117]. Согласно исследованию [95], в присутствии этих добавок ускоряется увод сульфат-ионов; соответственно в жидкой фазе их количество остается недостаточным для управления гидратацией СзА. Как видно из данных рис. 3.25, при высоком отношении СзА к гипсу добавки - водопонизители ускоряют образование эттрингита. Аналогичное объяснение может быть предложено ускоряющему действию сахарозы на первой стадии гидратации портландцемента [50] (см. разд. 3.3.1.4).
Проблема ликвидации коротких сроков схватывания белого и серого цемента типа I может быть решена добавлением гипса [95, 117]. Другие факторы, например гидратация полугидрата сульфата кальция, также должны быть включены в число тех, которые приводят к излишне коротким срокам схватывания цемента в присутствии органических добавок-водопонизителей [95].
Установлено также, что введение 0,1 % сахара ускоряет сроки начала схватывания и удлиняет конец схватывания высокоалюминатного высокощелочного цемента типа I [118], а 0,2—0,3 % этой добавки вызывает ложное схватывание. Указанное явление сопровождается более быстрым образованием тонкой сетки из кристаллов эттрингита. Что касается добавок лигносульфоната, то предотвращение раннего ускорения схватывания обеспечивает более позднее введение органических водопонизителей: при этом заметно удлиняются сроки и до начала и до конца схватывания цемента (см. разд. 3.3.1.4).
Влияние гидроксикарбоно - вых кислот на ложное схватывание портландцемента очень сходно с тем, которое наблюдается при введении лигносульфоната [97] (см. разд. 3.3.1.11). В работе [50] отмечено, что введение всего 0,05 % сахарозы предотвращает преждевременное загустевание смеси при использовании цемента, характеризующегося ложным схватыванием. Это можно объяснить ускорением первой стадии гидратации (см. разд. 3.3.1.4), в результате чего возрастает увод SCU-hohob из жидкой фазы; это, в свою очередь, предотвращает выпадение гипса.
С другой стороны, сахароза оказалась неэффективной при попытке ее использования для борьбы с ложным схватыванием цемента, вызванным аэрацией. Поскольку аэрация ответственна за инертность поверхности СзА, можно заключить, что сахарозу нельзя использовать для повторной активации аэрированной поверхности СзА-фазы.
Б. Ранняя гидратация (конец схватывания). Ранняя гидратация, как и ранняя прочность цементных материалов, замедляется в присутствии 0,01 % органических водопонизителей, причем этот результат не зависит от того, как влияли эти добавки на сроки до начала схватывания. Этот факт объясняется тем, что указанные добавки замедляют процессы гидратации цемента в раннем возрасте [119]. Ранняя гидратация С3А замедляется добавками и глюкозы и глюконата натрия (см. разд. 3.3.1.6 и 3.3.1.7), о чем свидетельствуют данные рис. 3.20; это. проявляется в понижении ранней прочности составов и в удлинении сроков конца схватывания цемента [38]. Как видно из рис. 3.30, введение 0,05 % сахарозы или 0,1 % глюконата натрия несколько снижает прочность образцов в возрасте 1 сут.
В. Более поздняя гидратация. Глюкоза, глюконат и лигносульфонат повышают степень гидратации C3S в более поздние сроки (см. рис. 3.20), даже если они замедляли гидратацию C3S в раннем возрасте (см. разд. 3.3.1.7). При содержании 0,2 % добавки степень гидратации портландцемента в возрасте 3 и 7 сут несколько выше, чем без добавки [120]. Эти результаты, очень сходные с теми, которые наблюдались при введении лигносульфоната (см. разд. 3.3.1.11), могут объяснить причины повышения прочности цементных материалов в более позднем возрасте в присутствии добавок сахарозы и глюконата (рис. 3.30).
Неорганические вещества. Некоторые неорга
нические добавки также можно использовать в качестве замедлителей схватывания и гидратации цемента. Однако их редко применяют в реальных условиях из-за их более высокой стоимости, чем органических веществ аналогичного назначения, токсичности отходов, содержащих эти продукты, и их низкой растворимости в нейтральных водных средах. К числу сильных замедлителей гидратации C3S принадлежат соли свинца, олова, меди, железа и алюминия [121]. Гидроксиды цинка, меди и свинца также тормозят гидратацию C3S [122—124].
|
R^Mna |
|
Рис. 3.30. Кинетика роста прочности портландцементного раствора при сжатии при введении в растворные образцы водопонизителей (В/Ц=0,47= = const) 1 — эталон; 2 — 0,05 % сахарозы; 5 — 0,1 % глю - коната натрия; 4 — 0,2 % глюконата натрия |
|
T, сут |
Добавки на основе цинка замедляют процессы гидратации C3S сильнее, чем СзА [124]. К замедлителям гидратации цемента относятся фосфаты и соли свинца, цинка, меди, мышьяка и сурьмы [61]. По влиянию на сроки до начала схватывания неорганические соли с одинаковым анионом располагаются в следующий ряд [126].
Zn2 + > Pb2 + > Cu2+> Sn2+> Cd2+.
Механизм торможения процессов гидратации обусловлен образованием на поверхности частиц цемента гелеобразных защитных пленок из труднорастворимых гидроксидов этих металлов [121, 122, 127, 128]. Однако гидратация цемента не прекращается, а лишь замедляется, поскольку эти пленки обладают диффузионной проницаемостью для воды [128]. Соответственно любые преобразования в микроструктуре пленок, например вызванные химическими превращениями или кристаллизацией, могут изменить их замедляющее действие в более позднем возрасте. Это относится к гидро - ксиду цинка и позволяет объяснить, почему гидроксид меди — более длительно действующий замедлитель гидратации цемента [128].
Вследствие торможения процессов гидратации цемента добавки замедляют также начальную стадию твердения и раннюю прочность бетона, однако для заданного типа добавок этот эффект зависит от их дозировки и вида цемента. Так, было найдено, что при введении 0,1—0,4 % РЬО прочность бетона при сжатии после некоторого начального периода, когда она была ниже, чем у этало
на, в дальнейшем превзошла эталон — бетон без добавки [122]. Однако эти данные противоречат тем, которые были получены в работе [129].
3.3.1.13. Влияние добавок водопонизителей-замедлителей на процессы гидратации цементов, отличных от портландцемента. Влияние таких добавок на гидратацию пуццоланового и шлакопортландцементов в целом аналогично их воздействию на портландцемент. Наиболее существенное различие заключается в более сильном замедляющем действии добавок на пуццолановый и шла - копортландцементы, чем на портландцемент.
В табл. 3.12 представлены данные о действии технического лигносульфоната - кальция (ЛСК) на портландцемент, а также на пуццолановый и шла - копортландцементы, изготовленные путем замены 30 % этого цемента на природный пуццолан и шлак [8]. Как видно, слабое ускорение начала схватывания, наблюдавшееся при введении 0,2 % ЛСК в составы на портландцементе, сменилось существенным замедлением процессов схватывания в составах на пуццолановом и шлакопортландцементах.
Нарастание прочности раствора на портландцементе в возрасте 3—28 сут в присутствии добавки лигносульфоната становится пренебрежимо малым при использовании пуццолано - вого и шлакопортландцемента (при одинаковом В/Ц, рис. 3.31). Испытания показали, что в сравнении с составами на портландцементе гидратацию составов на пуццолановом и шлакопортландцементе с помощью тех же добавок-водопонизителей удается замедлить на большие сроки. В табл. 3.13 приведены данные по содержанию Са(ОН)2 и потерям при прокаливании портландцемента, пуццоланового и шлакопортландцемента в возрасте 7 сут в присутствии 0,2 ЛСК и без добавки [8]. Меньшее содержание клинкера в образцах на пуццолановом и шлакопортландцементе означает, что в расчете на массу клинкерной части этих цементов дозировка добавки ЛСК выше. Это может служить объяснением причин более сильного торможения
|
Таблица 3.12. СРОКИ СХВАТЫВАНИЯ ПОРТЛАНДЦЕМЕНТА, ПУЦЦОЛАНОВ ОГО И ШЛАКОПОРТЛАНДЦЕМЕНТА ПРИ ВВЕДЕНИИ 0,2% ТЕХНИЧЕСКОГО ЛИГНОСУЛЬФОНАТА КАЛЬЦИЯ (ЛСК) |8)
|
|
Таблица 3.13. ВЛИЯНИЕ 0,2% ТЕХНИЧЕСКОГО ЛСК НА СОДЕРЖАНИЕ Са(ОН)2 И ПОТЕРИ ПРИ ПРОКАЛИВАНИИ (ППП)
|
Этой добавкой процессов гидратации пуццоланового и шлакопортландцементе, а в основе пониженного содержания
Са(ОН)г в этих составах лежит меньшее содержание в них портла ндцемента.
Перечисленные органические добавки — водопонизители обычно не используют при работе с высокоглиноземистым цементом, поскольку, например, введение 1 % лигносульфоната натрия не изменяет консистенции смеси [112]. Однако гидроксикарбоновые кислоты могут снизить водопотребность такого цемента [130].